
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:阅读理解
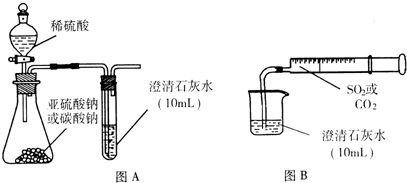
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)在标准状况下,能否用上述数据确定参加反应的CO2的体积?若能,试列式计算;若不能,请说明理由。
(2)能否用以上的数据确定NaOH物质的量浓度?若在上述CO2与NaOH反应后的溶液中不加入石灰水,而是加入足量CaCl2溶液,结果得到n g沉淀,设原NaOH溶液的物质的量浓度为c,则
当n=m时,c=______________________________________________;
当n=0时,c=______________________________________________;
当n<m时,c=_____________________________________________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年湖北省孝感高级中学高一上学期期末考试化学试卷(带解析) 题型:单选题
室温下将一定体积的CO2通入V L NaOH溶液中,已知NaOH完全反应,若在反应后的溶液中加入足量石灰水,得到Ag沉淀;若在反应后的溶液中加入足量CaCl2溶液,得到Bg沉淀,则下列说法正确的是( )
A.参加反应的CO2体积为0.224AL
B.用上述数据不能确定NaOH溶液的物质的量浓度
C.若A=B,则CO2与NaOH溶液反应的产物盐只有Na2CO3
D.B可能等于A、小于A或大于A
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com