
| A. | 溶液J焰色反应显黄色,则说明原溶液中存在Na+ | |
| B. | 沉淀G中加入盐酸溶解,滴加一滴KSCN溶液显红色,可以确定原溶液中有Fe3+ | |
| C. | X中不能确定的离子是 A13+、Fe3+、Na+、K+和C1- | |
| D. | 沉淀I一定是Al(OH )3 |
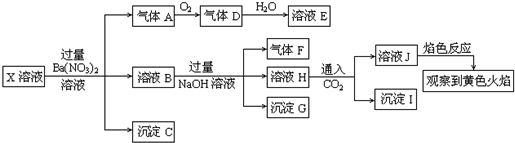
分析 ①强酸性溶液中CO32-、SO32-不能存在;
②X溶液中加入过量Ba(NO3)2溶液生成沉淀C是BaSO4,说明有SO42-存在;硝酸被还原生成气体A为NO,说明有还原剂Fe2+存在,(即3Fe2++4H++NO3-=3Fe3++NO↑+2H2O).
③溶液B加入过量NaOH溶液,生成的沉淀G为Fe(OH)3;生成的气体F为NH3,说明有NH4+存在.
④溶液H通入CO2生成沉淀I,由于前面加入过量的Ba(NO3)2溶液,引入了大量Ba2+,所以沉淀I中一定有BaCO3,又由于前面不能确定溶液X中是否存在A13+,所以这里也不能确定沉淀I中有A1(OH)3;溶液J的焰色反应呈黄色,说明溶液J中有Na+,但由于前面加入过量NaOH溶液,引入了较多的Na+,因此不能确定溶液X中是否存在Na+;因为焰色黄色能掩盖紫色焰色,所以不能确定溶液X中是否有K+;另外,上述实验过程还不能确定溶液X中是否存在C1-.
解答 解:①强酸性溶液中CO32-、SO32-不能存在;②X溶液中加入过量Ba(NO3)2溶液生成沉淀C是BaSO4,说明有SO42-存在;硝酸被还原生成气体A为NO,说明有还原剂Fe2+存在,(即3Fe2++4H++NO3-=3Fe3++NO↑+2H2O),在此反应中,Fe2+被氧化为Fe3+.③溶液B加入过量NaOH溶液,生成的沉淀G为Fe(OH)3;生成的气体F为NH3,说明有NH4+存在.④溶液H通入CO2生成沉淀I,由于前面加入过量的Ba(NO3)2溶液,引入了大量Ba2+,且前面加入的NaOH是过量的,所以沉淀I中一定有BaCO3,又由于前面不能确定溶液X中是否存在A13+,所以这里也不能确定沉淀I中有A1(OH)3;溶液J的焰色反应呈黄色,说明溶液J中有Na+,但由于前面加入过量NaOH溶液,引入了较多的Na+,因此不能确定溶液X中是否存在Na+;因为焰色黄色能掩盖紫色焰色,所以不能确定溶液X中是否有K+;另外,上述实验过程还不能确定溶液X中是否存在C1-.
A.通过以上分析知,不能确定原来溶液中是否含有钠离子,故A错误;
B.沉淀G为Fe(OH)3,但Fe3+可能是原来有的,也可能是Fe2+被氧化生成的,故B错误;
C.X中肯定存在Fe2+、NH4+、SO42-,A13+、Fe3+、Na+、K+和C1-不能确定,故C正确;
D.沉淀I中一定有BaCO3,又由于前面不能确定溶液X中是否存在A13+,所以这里也不能确定沉淀I中有A1(OH)3,故D错误;
故选C.
点评 本题考查常见离子的检验,如氨气的检验、铝离子的检验等,难度中等.


 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:解答题
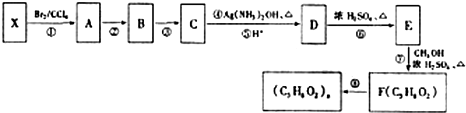
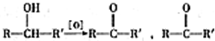 不易被氧化成羧酸
不易被氧化成羧酸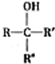 不易被氧化成醛或酮
不易被氧化成醛或酮
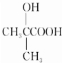 .
.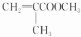 $→_{△}^{催化剂}$
$→_{△}^{催化剂}$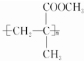 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 (R、R′代表烃基)
(R、R′代表烃基)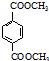 有多种同分异构体,同时满足下列条件的同分异构体有8种.
有多种同分异构体,同时满足下列条件的同分异构体有8种. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热蒸发皿和烧杯必须垫石棉网 | |
| B. | 除去乙醇中的乙酸,加入NaOH溶液后分液 | |
| C. | 配制0.1mol•L-1NaCl溶液的实验中,用托盘天平称取5.85gNaCl | |
| D. | 将硫酸铜溶液蒸发浓缩、冷却结晶得到CuSO4•5H2O晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
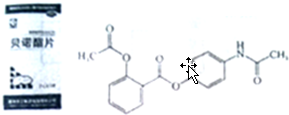
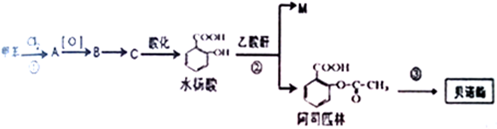
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl和H2SO4都属于酸 | B. | K2CO3和K2O都属于盐 | ||
| C. | NaOH和Na2CO3都属于碱 | D. | H2O和O2都属于氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁和稀硫酸反应 2Fe+6H+═2Fe3++3H2↑ | |
| B. | 向硫酸钠溶液中滴加氯化钡溶液 Ba2++SO42-═BaSO4↓ | |
| C. | 氯水加入到溴化钾溶液中 Br-+Cl2═Br2+Cl- | |
| D. | 碳酸钙溶于稀盐酸 CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学中的某些元素与生命活动密不可分.请回答下列问题:
化学中的某些元素与生命活动密不可分.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
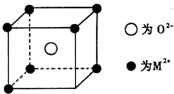 已知MO与CsCl的结构相似(如图2所示),MO晶体的密度为p g•cm-3,NA为阿伏加德罗常数,相邻的两个M2+的核间距为acm.写出Cs基态原子的价电子排布式6s1,MO的相对分子质量可以表示为ρa3 NA.
已知MO与CsCl的结构相似(如图2所示),MO晶体的密度为p g•cm-3,NA为阿伏加德罗常数,相邻的两个M2+的核间距为acm.写出Cs基态原子的价电子排布式6s1,MO的相对分子质量可以表示为ρa3 NA.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com