
【题目】为了测定铁铜合金的组成,将7.6g铁、铜合金加入100mL某浓度的稀硝酸中,待合金完全溶解后,共收集到NO气体2.24L(标准状况下),并测得溶液中H+的浓度为0.5molL﹣1 . 若反应前后溶液的体积变化忽略不计,则下列判断正确的是( )
A.上述反应中金属共失去电子0.1 mol
B.合金中,铜的质量为2.8 g
C.原硝酸的浓度:c(HNO3)=4.5 molL﹣1
D.要使溶液中的金属离子完全沉淀,需加5 molL﹣1的NaOH溶液60 mL
【答案】C
【解析】解:n(NO)= ![]() =0.1mol,则转移电子为0.1mol×(5﹣2)=0.3mol,反应后溶液中的c(H+)=0.5mol/L,则反应后剩余n(HNO3)=0.5mol/L×0.1L=0.05mol,设合金中Cu为xmol,Fe为ymol,由电子守恒可知:2x+3y=0.3mol,由合金的质量可知:64x+56y=7.6,解得x=0.075mol,y=0.05mol, A.由分析可知,金属共失去电子0.3 mol,故A错误;
=0.1mol,则转移电子为0.1mol×(5﹣2)=0.3mol,反应后溶液中的c(H+)=0.5mol/L,则反应后剩余n(HNO3)=0.5mol/L×0.1L=0.05mol,设合金中Cu为xmol,Fe为ymol,由电子守恒可知:2x+3y=0.3mol,由合金的质量可知:64x+56y=7.6,解得x=0.075mol,y=0.05mol, A.由分析可知,金属共失去电子0.3 mol,故A错误;
B.合金中,铜的质量为0.075mol×64=4.8 g,故B错误;
C.反应生成Cu(NO3)2、Fe(NO3)3和NO,以及剩余的硝酸,根据氮原子守恒可知,n(HNO3)=0.075×2+0.05×3+0.1+0.05=0.45mol,则c(HNO3)= ![]() =
= ![]() =4.5mol/L,故C正确;
=4.5mol/L,故C正确;
D.要使溶液中的金属离子完全沉淀,溶液中的溶质为NaNO3 , n(NaNO3)=n(NaOH)=0.075×2+0.05×3+0.05=0.35mol,V= ![]() =
= ![]() =0.07L=70mL,故D错误.
=0.07L=70mL,故D错误.
故选C.
n(NO)= ![]() =0.1mol,则转移电子为0.1mol×(5﹣2)=0.3mol,反应后溶液中的c(H+)=0.5mol/L,则反应后剩余n(HNO3)=0.5mol/L×0.1L=0.05mol,设合金中Cu为xmol,Fe为ymol,由电子守恒可知:2x+3y=0.3mol,由合金的质量可知:64x+56y=7.6,解得x=0.075mol,y=0.05mol,结合选项分析.
=0.1mol,则转移电子为0.1mol×(5﹣2)=0.3mol,反应后溶液中的c(H+)=0.5mol/L,则反应后剩余n(HNO3)=0.5mol/L×0.1L=0.05mol,设合金中Cu为xmol,Fe为ymol,由电子守恒可知:2x+3y=0.3mol,由合金的质量可知:64x+56y=7.6,解得x=0.075mol,y=0.05mol,结合选项分析.


科目:高中化学 来源: 题型:
【题目】下列除杂方法正确的是( )
A.乙烷中混有乙烯,将其通入酸性高锰酸钾溶液中洗气
B.乙烯中混有二氧化硫,将其通入氢氧化钠溶液中洗气
C.乙炔中混有硫化氢,将其通入溴水中洗气
D.溴苯中混有溴,加入汽油,振荡,用汽油萃取出溴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无土栽培中,须配制一定量含50molNH4Cl、16molKCl和24molK2SO4的营养液。若用KCl、NH4Cl和(NH4)2SO4三种固体来配制,三者的物质的量依次是(单位:mol):
A.2、64、24B.64、2、24
C.32、50、12D.16、50、24
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 利用丁达尔效应可以区分溶液和胶体
B. 胶体的分散质粒子直径大于1nm小于100nm,但不能通过半透膜
C. PM2.5是指大气中直径接近于2.5×10-6 m(1m=109 nm)的颗粒物,也称可吸入颗粒物,这些细颗粒物分散在空气中形成的分散系是胶体
D. 溶液的分散质粒子直径小于1nm,能通过滤纸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应 不属于取代反应的是( )
A.CH4+Cl2 ![]() CH3Cl+HCl
CH3Cl+HCl
B.CH2═CH2+HBr﹣→CH3﹣CH2Br
C.CH3CH2OH+CH3COOH ![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氧化还原反应:2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O,其中1mol氧化剂在反应中得到的电子为( )
A. 10mol B. 11mol C. 12mol D. 13mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣探究小组将一批废弃的线路板简单处理后,得到含Cu(70%)、Al(25%)、Fe(4%)及少量Au等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的流程: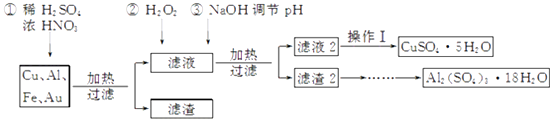
已知:Fe3+、Al3+、Cu2+开始沉淀至沉淀完全的pH范围分别为:2.2~3.2、4.1~5.0、5.3~6.6.
(1)得到滤渣1的主要成分为 .
(2)操作Ⅰ包含的实验步骤有:、冷却结晶、过滤、洗涤、干燥;过滤操作所用到的玻璃仪器有烧杯、玻璃棒和 .
(3)操作Ⅰ中常用无水乙醇对晶体进行洗涤,选用无水乙醇的原因是 .
(4)第②步加H2O2后发生反应的离子方程式为 .
(5)取上述硫酸铝晶体进行热重分析,其热分解主要分为三个阶段:323K~523K,553K~687K,当温度在1 043K以上不再失重,下表列出了不同温度下的失重率:[硫酸铝晶体化学式为Al2(SO4)318H2O,相对分子质量为666]
已知:失重%= ![]() ×100%.
×100%.
温度(K) | 失重(%) | |
第一阶段 | 323~523 | 40.54 |
第二阶段 | 553~687 | 48.65 |
第三阶段 | 1 043以上 | 84.68 |
通过计算确定(写出计算过程):
①失重第一阶段分解产物的化学式;
②失重第二阶段反应的反应化学方程式.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在AlCl3、MgCl2、MgSO4的混合溶液中,c(Al3+)=0.10mol/L,c(Mg2+)=0.25mol/L,c(Cl-)=0.50mol/L,则c(SO42-)为
A. 0.10mol/L B. 0.15mol/L C. 0.20mol/L D. 0.30mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com