
| A. |  利用图装置,可快速制取氨气 | |
| B. |  利用图装置,用饱和碳酸钠溶液分离CH3CH2OH和CH3COOC2H5混合液 | |
| C. |  利用图装置,可制取乙酸乙酯 | |
| D. |  利用图装置,可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性 |
分析 A.浓氨水与生石灰混合可制备氨气;
B.饱和碳酸钠溶液与乙醇互溶,与乙酸乙酯分层;
C.乙醇、乙酸易溶于水,导管口不能在液面下;
D.浓硫酸使蔗糖脱水后,C与浓硫酸反应生成二氧化碳、二氧化硫,二氧化硫使品红褪色,与高锰酸钾发生氧化还原反应.
解答 解:A.浓氨水与生石灰混合可制备氨气,则图中固液装置可制备氨气,故A正确;
B.饱和碳酸钠溶液与乙醇互溶,与乙酸乙酯分层,则图中分液装置可分离,故B正确;
C.乙醇、乙酸易溶于水,导管口不能在液面下,则图中装置以发生倒吸,故C错误;
D.浓硫酸使蔗糖脱水后,C与浓硫酸反应生成二氧化碳、二氧化硫,二氧化硫使品红褪色,与高锰酸钾发生氧化还原反应,则图中装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性,故D正确;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握实验装置的作用、物质的性质、气体的制备实验、混合物分离提纯等为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:解答题
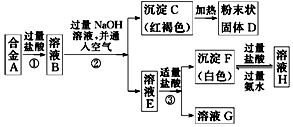 铁和铝是日常生活中用途广泛的金属.
铁和铝是日常生活中用途广泛的金属.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{20}^{40}$Ca 和${\;}_{18}^{40}$Ar | B. | D和T | ||
| C. | H2 O和H2 O2 | D. | O3 和O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某温度时,在一个2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示.下列说法不正确的是( )
某温度时,在一个2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示.下列说法不正确的是( )| A. | 该反应的化学方程式为3X+Y?2Z | |
| B. | 容器内混合气体的平均摩尔质量保持不变表明该反应一定达到平衡状态 | |
| C. | 平衡时,体系的压强是开始时的1.8倍 | |
| D. | 平衡时,Y的体积分数为50% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl 的溶解性强于 H2S | B. | 氯的最高价为+7 价 | ||
| C. | H2S 中的 S2-能被 Cl2氧化 | D. | HCl O 的氧化性强于 H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量a g的C2H4和C3H6的混合物中共用电子对数目为$\frac{3a{N}_{A}}{14}$ | |
| B. | 常温下,0.1 mol•L-1的NaOH溶液中含有OH一的数目为0.1NA | |
| C. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为2NA | |
| D. | 7.8g过氧化钠固体中阴、阳离子总数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 压强/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/(mol•L-1) | 0.08 | 0.20 | 0.44 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com