
【题目】CH4(其中C为-4价)既是一种重要的能源,也是一种重要的化工原料。
(1)已知8.0gCH4完全燃烧生成二氧化碳和液态水时放出444.8kJ热量。若一定量的甲烷完全燃烧生成二氧化碳和液态水时放出1334.4kJ的热量,则需要标准状况下的氧气约___L。
(2)以CH4为燃料可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理如图甲所示,通入2.24L(已换算为标准状况)a气体时,通过质子交换膜转移的H+数目为___(设NA为阿伏加德罗常数的值)。

(3)在一定温度和催化剂作用下,CH4与CO2可直接转化成乙酸,这是实现“减排”的一种研究方向。
①在不同温度下,催化剂的催化效率与乙酸的生成速率如图乙所示,则该反应的最佳温度应控制在___℃左右。
②该反应催化剂的有效成分为偏铝酸亚铜(CuAlO2,难溶物)。将CuAlO2溶解在稀硝酸中生成两种盐并放出NO气体,其反应的离子方程式为___。
③CH4还原法是处理NOx气体的一种方法。已知一定条件下CH4与NOx反应转化为N2、CO2和H2O,若标准状况下8.96LCH4可处理22.4LNOx,则x值为___。
【答案】67.2 0.8NA 250℃ 3CuAlO2+16H++NO3-=3Al3++3Cu2++NO↑+8H2O 1.6
【解析】
(1)已知8.0gCH4完全燃烧生成液体水放出444.8kJ热量,则1mol即16g燃烧放出的热量为![]() kJ,现有一定量的甲烷完全燃烧生成二氧化碳和液态水时放出1334.4kJ的热量,甲烷的物质的量为
kJ,现有一定量的甲烷完全燃烧生成二氧化碳和液态水时放出1334.4kJ的热量,甲烷的物质的量为![]() mol=1.5mol,根据1mol甲烷完全燃烧需要2mol氧气,故1.5mol甲烷完全燃烧需要3mol氧气,故标况下氧气的体积为3mol
mol=1.5mol,根据1mol甲烷完全燃烧需要2mol氧气,故1.5mol甲烷完全燃烧需要3mol氧气,故标况下氧气的体积为3mol![]() 22.4L/mol=67.2L,故答案为:67.2;
22.4L/mol=67.2L,故答案为:67.2;
(2)由图可知,通入气体a的一端发生氧化反应,故应通入甲烷,该极为负极,通入b为氧气,获得电子,酸性条件下结合氢离子生成水,负极电极反应式为:CH4-8e-+2H2O=CO2+8H+,正极反应式为:O2+4e-+4H+=2H2O,当1mol甲烷反应时通过质子交换膜转移的H+为8mol,2.24L甲烷为0.1mol,故反应完通过质子交换膜转移的H+数目为0.8NA;故答案为:0.8NA;
(3)①从图象可知:250℃时乙酸反应速率最大、催化活性,故选择250℃;故答案为:250℃;
②CuAlO2溶解在稀硝酸中生成两种盐并放出NO气体,生成的盐为硝酸铝、硝酸铜,反应还有水生成,反应离子方程式为:3CuAlO2+16H++NO3-=NO↑+3Al3++3Cu2++8H2O;故答案为:3CuAlO2+16H++NO3-=NO↑+3Al3++3Cu2++8H2O;
③根据得失电子转移守恒,则:8.96L×[4-(-4)]=22.4L×2x,解得x=1.6;故答案为:1.6。


 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
【题目】金银花有效活性成分为绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如图所示,下列有关绿原酸的说法正确的是( )
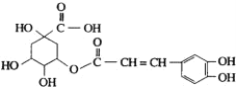
A. 绿原酸的分子式为C16H8O9
B. 1mol 绿原酸最多与7molNaOH反应
C. 1个绿原酸分子最多与4mol氢气反应
D. 绿原酸分子中有4种化学环境不同的氢原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸碱中和滴定是中学化学常见实验。
Ⅰ.下图表示50mL酸式滴定管中液面的位置,如果液面处的读数是a,则滴定管中剩余液体的体积是______mL。
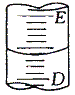
A、a B、大于a C、小于(50-a) D、大于(50-a)
Ⅱ.某同学欲测定某浓硫酸样品的物质的量浓度,进行了以下实验操作:
A 冷却至室温后,在100mL容量瓶中定容配成100mL稀硫酸。
B 量取20.00mL稀硫酸于锥形瓶中并滴入几滴指示剂。
C 将酸式滴定管和碱式滴定管用蒸馏水洗涤干净,并用各待盛溶液润洗。
D 将物质的量浓度为1.50 mol·L-1的标准NaOH溶液装入碱式滴定管,调节液面记下读数V1。
E 继续滴定至终点,记下读数为V2。
F 在锥形瓶下垫一张白纸,把锥形瓶移到碱式滴定管下小心滴入NaOH标准溶液,边滴边摇动锥形瓶。
G 量取浓硫酸样品5 mL,在烧杯中用蒸馏水溶解。
H 重复以上实验。
请回答下列问题:
(1)该实验正确操作步骤的顺序为____→ A →_____→_____→D→_____→_____→ H(用编号字母填写)。
(2)量取5mL浓硫酸的仪器是________________________;量取20.00mL稀硫酸的仪器是_________。
(3)选用的指示剂是_____________。滴定过程中,视线应注视____________________;判断到达滴定终点的现象是________________;读数时,视线应____________(填“高于”、“低于”或“相平于”)溶液凹液面的最低处。
(4)下表是实验测得的有关数据:
滴定序号 | 待测稀硫酸的体积(mL) | 所消耗NaOH标准溶液液的体积(mL) | |
V1 | V2 | ||
① | 20.00 | 0.50 | 22.60 |
② | 20.00 | 6.00 | 27.90 |
请计算出该浓硫酸样品的浓度为____________mol·L-1 (不必写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机化合物对应类别的同分异构体数目最少的是(不考虑立体异构)
选项 | A | B | C | D |
分子式 | C9H12 | C5H12O | C4H8O2 | C4H8FCl |
类别 | 芳香烃 | 醇 | 酯 | 卤代烃 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是巨大的资源宝库,从其中提取食盐和溴的过程如图所示。下列描述错误的是( )
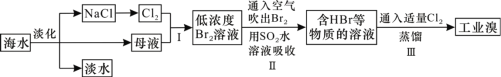
A.淡化海水的方法主要有蒸馏法、电渗析法、离子交换法
B.以NaCl为原料可以生产烧碱、纯碱、金属钠、氯气、盐酸等化工产品
C.SO2水溶液吸收Br2的离子反应方程式为Br2+SO2+2H2O=4H++SO42-+2Br-
D.步骤Ⅱ中鼓入热空气吹出溴,是因为溴蒸气的密度比空气的密度小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列说法错误的是( )
A. 1mol苯乙烯(![]() )中含有的C=C数为NA
)中含有的C=C数为NA
B. 在标准状况下,11.2L四氯化碳含有分子数为0.5NA
C. 2.8g乙烯和丙烯的混合气体中所含碳原子数为0.2NA
D. 1mol甲基含9NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.通常情况(同温同压)下,金刚石比石墨稳定
B.分解反应不一定都是吸热反应
C.1mol CH3CH2CN与H2在一定条件下完全加成,常需2mol H2
D.常温常压时,KOH与HCl两种稀溶液完全反应的热化学方程式是H+(aq)+OH-(aq)=H2O(l) △H=-57.3 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年发生的天津港有关仓库物品爆炸涉及电石与氰化钠等,而CN-作为配位剂可形成[Au(CN)2]-、[Ag(CN)2]-、[Zn(CN)4]2-、[Fe(CN)3]4-、[Fe(CN)4]3-等。常把原子个数相同,最外层电子数也相同的微粒称作等电子体,同时它们的结构相似。
试分析并回答:
(1)电石的主要成分是__________(写化学式),其中阴离子与CN-是等电子体,写出CN-的电子式:__________。
(2)有着“闪电式死亡”之称的剧毒物品氰化钠,在地面水中很不稳定,pH大于7时,可被氧气氧化成碳酸盐和氨气,试写出该反应的离子方程式:______。
(3)以剧毒物氰化钠比例,从反应原理角度去思考如何防止其污染。试提出两个有关应用的好方案________、_______。
(4)电石中还含有CaS等,与水反应还有H2S的生成,H2S完全氧化生成S2,S2又可催化氧化生成SO3。已知2SO2(g)+O2(g)![]() 2SO3(g) △H<0。某温度下,将2mol SO2和1 mol O2置于10L密闭容器中,反应达到平衡后,SO2的平衡转化率(a)与体系总压强(p)的关系如图所示。
2SO3(g) △H<0。某温度下,将2mol SO2和1 mol O2置于10L密闭容器中,反应达到平衡后,SO2的平衡转化率(a)与体系总压强(p)的关系如图所示。
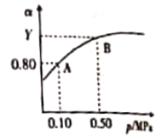
则①Y大于0.8的原因是__________;
②K(A)____________(填“大于”“等于”或“小于”)K(B);
③若压强为0.10MPa,试做出T1、T2不同温度下(设T2< T1)SO2转化率与温度的关系图__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
ⅠA | 0 | ||||||||
1 | ① | ⅡA | …… | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | |||||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||||
4 | ⑨ | ||||||||
(1)②元素简单氢化物的电子式是________________________。
(2)③、④、⑤、⑦元素的离子半径由大到小的顺序为______________。
(3)⑥元素的名称为_______________,举出⑥单质的一个应用____________。
(4)上述所有元素中最高价氧化物对应的水化物的酸性最强的是_____________, 写出一个能证明⑧比⑦非金属性强的一个离子反应方程式___________________。
(5)有两种化合物A和B都由①③④⑦四种元素组成。若A与B在水溶液中能发生离子反应,则该反应的离子方程式为____________。
(6)⑨与④的原子序数之差为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com