
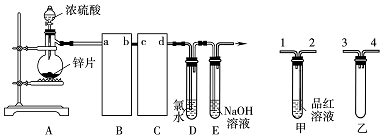
分析 (1)根据仪器的构造写出其名称;
(2)B装置为安全瓶,防止倒吸,应该装置甲;C用品红溶液具有二氧化硫,导管应该长进短出;
(3)证明生成二氧化硫气体,二氧化硫通入装置甲中品红溶液会褪色或通入装置D中氯水溶液颜色褪去;
(4)方案工:向第一份溶液中加入AgNO3溶液,有白色沉淀生成证明生成氯化银沉淀,但不能证明氯离子是二氧化硫还原得到,氯水中存在氯离子;
方案Ⅱ:向第二份溶液加入品红溶液,红色褪去,可能是二氧化硫漂白性或氯水中次氯酸的漂白性;
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀说明生成硫酸钡沉淀,证明二氧化硫被氯气氧化生成硫酸;
(5)锌和浓硫酸反应生成硫酸锌和二氧化硫和水,当硫酸浓度变稀时,锌与稀硫酸反应生成硫酸锌和氢气;
(6)E中氢氧化钠溶液吸收二氧化硫气体得到溶液中存在电荷守恒.
解答 解:(1)根据图示可知,A装置中,盛装锌片的仪器名称为蒸馏烧瓶,
故答案为:蒸馏烧瓶;
(2)通常状况下,1体积水中可溶解40体积的二氧化硫气体,装置乙可防止二氧化硫与品红作用时被吸入锌与硫酸反应的容器中;二氧化硫与品红溶液作用,需长管进,所以导管连接顺序为:a接4(或3)→b→c→2,乙导气管略露出胶塞起到安全瓶的作用,可以防止倒吸,
故答案为:3(或4);2;防止倒吸;
(3)二氧化硫可使品红溶液褪色,则C中品红溶液褪色可检验二氧化硫的存在,从而证明浓硫酸具有强氧化性,或D中氯水褪色,也可以证明生成二氧化硫,
故答案为:C中品红溶液褪色或D中氯水褪色;
(4)方案工:向第一份溶液中加入AgNO3溶液,有白色沉淀生成证明生成氯化银沉淀,但不能证明氯离子是二氧化硫还原得到,氯水中存在氯离子也可以反应生成氯化银沉淀,故Ⅰ错误;
方案Ⅱ:向第二份溶液加入品红溶液,红色褪去,可能是二氧化硫漂白性或氯水中次氯酸的漂白性,不能证明二氧化硫具有还原性,故Ⅱ错误;
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀说明生成硫酸钡沉淀,证明二氧化硫被氯气氧化生成硫酸,结合钡离子生成硫酸钡沉淀,二氧化硫和氯化钡不反应,故Ⅲ正确;
分析可知上述方案中Ⅲ正确,D中发生反应的离子方程式为:Cl2+SO2+2H2O=4H++SO42-+2Cl-,
故答案为:Ⅲ;Cl2+SO2+2H2O=4H++SO42-+2Cl-;
(5)锌为较活泼的金属,在金属活动顺序表中排在氢的前面,所以锌和稀硫酸反应生成硫酸锌和氢气,反应一段时间后,气泡量又会明显增加”的原因用化学方程式表示为:Zn+H2SO4(稀)═ZnSO4+H2↑,
故答案为:Zn+H2SO4(稀)═ZnSO4+H2↑;
(6)E中氢氧化钠溶液吸收二氧化硫气体得到溶液中存在电荷守恒式为c(Na+)+c(H+)=c(OH-)+c(HSO3-)+2c(SO32-),当E中溶液呈中性时c(H+)=c(OH-),溶液中c(Na+)=c(HSO3-)+2c(SO32-),
故答案为:c(HSO3-)+2c(SO32-).
点评 本题考查浓硫酸的性质,题目难度中等,明确浓硫酸、稀硫酸分别与锌反应的原理为解答关键,注意熟练掌握二氧化硫的性质及检验方法,试题知识点较多,考查较全面,有利于培养学生的分析能力及化学实验能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | x等于6 | |
| B. | 性质稳定,不易脱色 | |
| C. | 易溶解于强酸和强碱 | |
| D. | 可用氧化物形式表示为BaO•CuO•2SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaNO2 | B. | AgNO3 | C. | BaCO3 | D. | BaSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
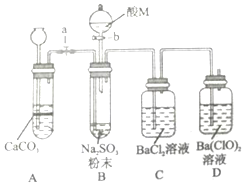 SO2是一种有毒气体,但可用于酒精的防腐剂,可以抵抗微生物的侵袭.甲同学用Na2SO4制备SO2,并验证SO2的部分性质.设计了如下实验步骤及装置:
SO2是一种有毒气体,但可用于酒精的防腐剂,可以抵抗微生物的侵袭.甲同学用Na2SO4制备SO2,并验证SO2的部分性质.设计了如下实验步骤及装置:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ②③⑥ | C. | ②⑤⑥ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光化学烟雾的主要原因与排放SO2有关 | |
| B. | 工业上用二氧化硫来漂白纸浆、毛、丝、草帽、食品等 | |
| C. | 闪电时,大气中常伴有少量的NO2产生 | |
| D. | 正常雨水的PH小于5.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学变化过程中一定伴随着能量变化 | |
| B. | 放热反应可能需要加热才能进行 | |
| C. | 吸热反应只能在加热条件下才能进行 | |
| D. | 天然气在空气中燃烧时,能量转化形式不止一种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com