
【题目】2020年5月5日晚18时00分,我国载人空间站货物返回舱试验舱在我国文昌航天发射场点火升空,5月8日飞船试验船返回舱在东风着陆场预定区域成功着陆,试验取得圆满成功。金属铍(Be)是火箭、航空、宇宙航行的重要材料,工业上以含铍废渣(主要成分是Be和MgF2)为原料制备金属铍的工艺流程。如图:
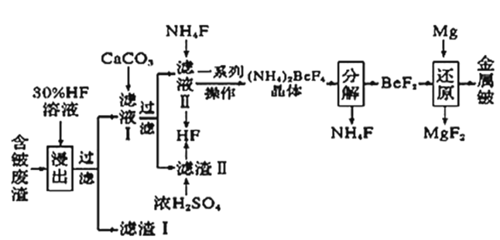
已知:MgF2和CaF2难溶于水。回答下列问题:
(1)提高浸出速率的方法有___、__(任写两项);已知滤液Ⅰ中铍元素的存在形式为H2BeF4,写出“浸出”过程中发生反应的化学方程式:__。
(2)该流程中可循环利用的物质是__;滤渣Ⅱ与浓硫酸发生反应的化学方程式为___;已知(NH4)2BeF4易溶于水,且其在水中的溶解度随温度的升高而大幅度增大,从NH4F与滤液Ⅱ发生反应后所得溶液中获得(NH4)2BeF4晶体的“一系列操作”具体是指__过滤、洗涤、干燥。
(3)“分解”过程中产生的BeF2在熔融状态下不能导电,其电子式为___;“还原”过程可以用金属镁制备金属铍的原因是__。
【答案】粉碎废渣 增大HF溶液的浓度适当升高温度、充分搅拌 Be+4HF=H2BeF4+H2↑ HF、NH4F CaF2+H2SO4(浓)![]() CaSO4+2HF↑ 蒸发浓缩、冷却结晶
CaSO4+2HF↑ 蒸发浓缩、冷却结晶 ![]() 镁的还原性比铍强
镁的还原性比铍强
【解析】
由流程可知,含铍废渣以氢氟酸浸取,过滤后得到滤渣I为MgF2,滤液I中加入碳酸钙后过滤,得到滤渣II(CaF2)和滤液II;向滤液II中加入氯化铵,经一系死操作得到(NH4)2BeF4晶体,该晶体经分解得到氟化铍;氟化铍用镁还原得到金属铍。
(1)含铍废渣以30%的氢氟酸浸取,要提高浸出速率,可以采用的方法有粉碎废渣或充分搅拌以提高反应物的接触面积,也可以适当增大HF溶液的浓度或适当升高温度;滤液Ⅰ中铍元素的存在形式为H2BeF4,则废渣听金属铍在“浸出”过程中发生反应的化学方程式为Be+4HF=H2BeF4+H2↑。
(2)由流程可知,滤渣II经浓硫酸处理后以及滤液II与氟化铵反应后均可生成HF,而(NH4)2BeF4分解后可以生成氯化铵,由于该流程中要用到氢氟酸和氟化铵,故该流程中可循环利用的物质是HF、NH4F;滤渣Ⅱ与浓硫酸发生反应,是利用难挥发酸制备挥发性酸,该反应的化学方程式为CaF2+H2SO4(浓)![]() CaSO4+2HF↑;由于(NH4)2BeF4易溶于水,其在水中的溶解度随温度的升高而大幅度增大,而且其受热易分解,故从NH4F与滤液Ⅱ发生反应后所得溶液中获得(NH4)2BeF4晶体的“一系列操作”应包括:、过滤、洗涤、干燥。
CaSO4+2HF↑;由于(NH4)2BeF4易溶于水,其在水中的溶解度随温度的升高而大幅度增大,而且其受热易分解,故从NH4F与滤液Ⅱ发生反应后所得溶液中获得(NH4)2BeF4晶体的“一系列操作”应包括:、过滤、洗涤、干燥。
(3)“分解”过程中产生的BeF2在熔融状态下不能导电,则其为共价化合物,故其电子式为![]() ;由于铍和镁均为第IIA的元素,镁的金属性强于铍,因此,“还原”过程可以用金属镁制备金属铍的原因是:镁的还原性比铍强。
;由于铍和镁均为第IIA的元素,镁的金属性强于铍,因此,“还原”过程可以用金属镁制备金属铍的原因是:镁的还原性比铍强。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在一定条件下,x A + y B ![]() z C的反应达到平衡。
z C的反应达到平衡。
(1)已知A、B、C都是气体,在减压后平衡向逆反应方向移动,则x、y、z之间的关系是_______。
(2)加热后C的质量分数减少,正反应是___________________反应。(填“吸热”或“放热”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白屈菜有止痛、止咳等功效,从其中提取的白屈菜酸的结构简式如图所示。下列有关白屈菜酸的说法中不正确的是( )

A.白屈菜酸的同分异构体中可能含有芳香族化合物
B.所有碳原子可以共面
C.1mol白屈菜酸完全燃烧需要O2的物质的量为4mol
D.能通过加聚反应形成高分子物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组探究铁与氯气的反应途径及产物。
(问题提出)
(1)资料1:液氯能在钢瓶中储存。
资料2:铁与氯气在加热条件下能发生反应
资料3:铁与氯水能反应。实验:将铁粉放入氯水中,铁粉溶解,无气泡产生。
①经检验氯水呈酸性,原因是________(用化学方程式表示)。
②依据实验现象,判断氯水中与Fe反应的微粒可能为_________。
据此,小组认为Fe与Cl2的反应与温度、湿度有关,探究如下。
(实验探究) 资料:高于300℃时FeCl3升华
(2)湿润的Cl2与Fe的反应:
实验 | 装置 | 操作及现象 |
Ⅰ |
| 常温时将铁丝伸入A中,铁丝迅速变黑 |
Ⅱ | 将红热的铁丝伸入A中,铁丝剧烈燃烧,产生大量棕黄色烟。 |
①实验Ⅰ,向A中加水,经检验产物中有FeCl2,推测其形成的可能途径:
途径一: Fe + Cl2 = FeCl2
途径二: 2Fe + 3Cl2 = 2FeCl3,_________。
②实验Ⅱ,_________(填操作和现象),A中产物含+3价铁。
(3)干燥的Cl2与Fe的反应:
实验 | 装置 | 操作及现象 |
Ⅲ |
| 常温时将铁丝伸入A中, 铁丝慢慢变 黑,大量气体剩余。 |
Ⅳ | 将红热的铁丝伸入A中,铁丝剧烈燃烧,产生大量棕黄色烟。 |
实验Ⅲ中有大量Cl2剩余,实验Ⅳ几乎无Cl2剩余,原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】橡胶分解后的产物是碳氢化合物,它含碳88.2%、氢11.8%,此烃的蒸气密度是同温同压下氢气密度的34倍,求它的分子式,此物质0.5mol能与160g溴单质起加成反应,在生成物中溴原子是分布在不同的碳原子上的,进一步研究时,又知溴代物结构上有一个碳原子是在支链上,根据这些条件,写出该碳氢化合物的分子式、结构简式并用系统命名法命名。______、______、_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素是地球大气中含量最多的元素,请完成下列有关问题:
(1)写出氮元素的原子结构示意图:_____________。
(2)通常情况下,氮气性质不活泼,其原因是__________。
A.氮分子是双原子分子 B.氮元素的非金属性很强
C.氮原子的半径较小 D.破坏氮分子中的化学键很难
(3)N2的电子式:__________,将空气中的氮气转化为氮的化合物的过程称为固氮。下列能实现人工固氮的是_______
A.N2和H2在一定条件下反应生成NH3
B.雷雨闪电时空气中的N2和O2化合生成NO
C.NH3经过催化氧化生成NO
D.NH3和HNO3反应生成NH4NO3
(4)氨气的电子式:__________________。
(5)实验室通常用加热消石灰与氯化铵固体的方法来制取氨气。写出此反应的化学方程式______________。
(6)下面是实验室制取氨气的装置和选用的试剂,其中错误的是________。
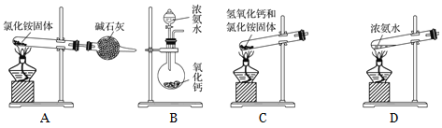
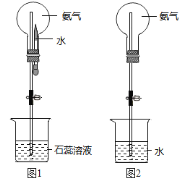
(7)用圆底烧瓶收集干燥的氨气,用图1装置进行喷泉实验,挤压滴管的胶头时,可以得到红色喷泉,原因(用方程式表示) _________________________。
(8)如果只提供如图2的装置,请说明引发喷泉的方法__________________________。
(9)NH4NO3是常用的铵态氮肥,在施用时若受热会释放出________而降低肥效。检验NH4+的方法是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素的A、B、C在元素周期表中的位置如图所示,已知A、B、C三种元素的原子核外电子数之和等于B的质量数,B原子核内质子数和中子数相等。据此填空:
![]()
(1)A的氢化物分子式为___________。
(2)B的元素符号为_________,原子结构示意图为______,在周期表中位于第_______周期_______族;
(3)C的单质分子式为___________,C的单质溶于水所得溶液叫____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟他胺G是一种可用于治疗肿瘤的药物。实验室由芳香烃A制备G的合成路线如图:

请回答下列问题:
(1)A的化学名称为__;C中官能团的名称是___。
(2)③的反应试剂和反应条件分别是__,该反应类型是__。
(3)T(C7H7NO2)是E在碱性条件下的水解产物的酸化产物,同时符合下列条件的T的同分异构体有__种。其中核磁共振氢谱上有4组峰且峰面积比为1:2:2:2的物质的结构简式为__。
①—NH2直接连在苯环上②能与新制氢氧化铜悬浊液共热产生红色固体
(4)参照上述合成路线,以CH3CH2COCl和![]() 为原料,经三步合成某化工产品
为原料,经三步合成某化工产品![]() 的路线为__(其他无机试剂任)。
的路线为__(其他无机试剂任)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,我国秋冬季雾霾天气呈现常态化趋势,造成严重空气污染,对人类身心健康造成极大威胁。硫酸盐气溶胶作为PM2.5的主要构成成分,是雾霾产生的一个重要元凶。科学家最近发现了一种利用水催化促进硫酸盐形成的化学新机制。如图所示:
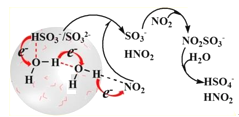
(1)NO2和SO2作为大气初期污染物的主要成分,主要来自_____。
(2)电子传递可以促进HSO![]() 中O—H键的解离,进而形成中间体SO
中O—H键的解离,进而形成中间体SO![]() ,反应的离子方程式为_____。
,反应的离子方程式为_____。
(3)通过“水分子桥”,处于纳米液滴中的SO![]() 或HSO
或HSO![]() 可以将电子快速转移到周围的气相NO2分子。观察图示可知“水桥”主要靠____形成。写出HSO
可以将电子快速转移到周围的气相NO2分子。观察图示可知“水桥”主要靠____形成。写出HSO![]() 与NO2间发生的总反应的离子方程式:_____。
与NO2间发生的总反应的离子方程式:_____。
(4)亚硝酸(HNO2)是一种弱酸,酸性比醋酸稍强,极不稳定,只能存在于稀的水溶液中,加热时发生歧化反应,生成一种强酸和一种遇空气变为红棕色的气体,写出该反应的化学方程式:_____。
(5)结合题中信息,请写出一种鉴别NaNO2和NaCl的方法:_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com