
将一定量的铝粉、氧化铝、氧化镁的混合物加入到300mL4mol/L的稀硫酸中,生成标准状况下6.72L气体。向反应后的溶液中滴加一定物质的量浓度的KOH溶液时,所得沉淀的物质的量(mol)与滴加KOH溶液的体积(mL)之间的关系如图所示:

(1)OA对应反应的离子方程式为________________,BC对应反应的离子方程式为_________________;
(2)c(KOH)=_________mol/L,混合物中氧化铝的物质的量为_____mol;
(3)A点对应的数值为_______;
(4)在中学阶段,实验室里检验B点对应的溶液中的阳离子时,所观察到的现象是___________。
(5)向C点对应的溶液中通入足量的CO2所发生反应的离子方程式为__________________。
科目:高中化学 来源:2016-2017学年湖北省宜昌市高二上学期期末考试化学试卷(解析版) 题型:选择题
在下列各溶液中,一定能大量共存的离子组是
A. 常温下水电离的c(H+)为1×10-12mol/L的溶液中:Fe2+、Na+、SO42-、NO3-
B. 滴加石蕊后呈蓝色的溶液中:K+、AlO2-、Cl-、HCO3-
C. 含有大量HCO3-的澄清透明溶液中:K+、Al3+、SO42-、Na+
D. 常温下c(OH-)/c(H+)=1014的溶液中:K+、Ba2+、Cl-、Br-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省天水市高二下学期开学考试(寒假作业检测)化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. 由水电离的H+离子浓度等于10﹣12mol/L的溶液中:Na+、K+、NO3﹣、HCO3﹣
B. pH=1的溶液中:Fe2+、NO3﹣、SO42﹣、Na+
C. 加酚酞呈红色的溶液中:CO32﹣、Cl﹣、F﹣、NH4+
D. c(H+)/C(OH﹣)=1012的溶液中:NH4+、NO3﹣、Cl﹣、Fe3+
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省景德镇市高二(素质班)上学期期末考试化学试卷(解析版) 题型:选择题
原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、7、1。a-的电子层结构与氦相同,b和c的次外层有8个电子,c-和d+的电子层结构相同。下列叙述错误的是( )
A. 元素的非金属性次序为c>b>a
B. a和其他3种元素均能形成共价化合物
C. d和其他3种元素均能形成离子化合物
D. 元素a 、b、c各自最高和最低化合价的代数和分别为0、4、6
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省景德镇市高二(素质班)上学期期末考试化学试卷(解析版) 题型:选择题
科学家尝试用微生物电池除去废水中的有害的有机物,其原理如图所示。下列有关说法错误 的是( )
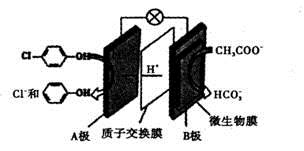
A. A极电极反应式为: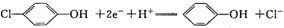
B. B极电极反应式为: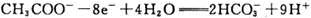
C. 溶液中的阴离子由A极向B极移动
D. 该微生物电池在高温条件下无法正常工作
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省庄河市高一上学期期末考试化学试卷(解析版) 题型:选择题
甲、乙两种溶液中分别含有大量的Cu2+、K+、H+、Cl-、CO32-、OH-这6种离子中的3种(两种溶液中的离子不重复),已知乙溶液为无色溶液,则甲溶液中大量存在的离子是( )
A. Cu2+、H+、Cl- B. K+、OH- 、CO32- C. CO32-、OH-、Cl- D. K+、H+、Cl-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省庄河市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列反应的离子方程式书写正确的是( )
A. 氯气溶于水:Cl2+H2O=Cl-+ClO-+2H+
B. 金属钠加入稀硫酸中:Na +2H+=Na++ H2↑
C. 明矾溶液中加入足量Ba(OH)2溶液:SO42-+Al3++Ba2++4OH-=AlO2-+BaSO4↓+2H2O
D. 向含有稀盐酸的氯化亚铁溶液中通入氧气:4Fe2++O2+4H+═4 Fe3++2H2O
查看答案和解析>>
科目:高中化学 来源:2017届广西省高三2月份模拟演练理综化学试卷(解析版) 题型:简答题
电子级钴的氧化物用于半导体工业和电子陶瓷等领域,是一种纯度很高的氧化物。现从废料(含Co3O4、Al、Si、Li2O、Fe2O3等物质)中提纯电子级钴的氧化物,其工业制取流程如下:
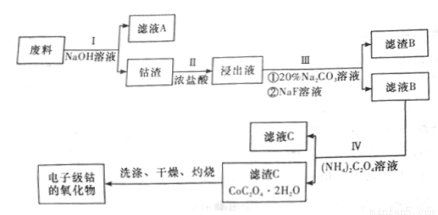
已知:
①物质的溶解性:LiF难溶于水,Li2CO3微溶于水;②钴元素常见的化合价为+ 2和+ 3;
③部分金属离子形成氢氧化物沉淀的pH见下表。
Fe3+ | Co2+ | Co3+ | Al3+ | |
pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
(1)废料在处理前要粉碎,其主要目的是(回答两个方面)___________;
步骤I得到的滤液A中的溶质为___________(填化学式)。
(2)步骤II中有黄绿色气体生成,有关含钴化合物发生反应的离子方程式为_________。
(3)步骤III中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH的取值范围为___________;滤渣B的主要成分为____________。
(4)步骤I、III、IV中均用到的分离提纯方法为_______,在实验室中完成该操作用到的玻璃仪器是__。
(5)5.49gCoC2O4·2H2O(其相对分子质量为183)经过反复洗涤、干燥后,进行灼烧,其热重分析如下表。
温度范围/℃ | 固体质量/g |
150~210 | 4.41 |
290~320 | 2.25 |
400~500 | 2.41 |
290℃~320℃时若生成两种气体,则发生反应的化学方程式为___________,400℃~500℃所得固体的化学式为__________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省盐城市高二学业水平模拟(一)化学试卷(解析版) 题型:选择题
下列物质中既含有离子键又含有共价键的是( )
A. NH4Cl B. NaCl C. H2O D. Cl2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com