
【题目】如图表示AlCl3溶液与NaOH溶液滴加过程中微粒数量的关系曲线。 判断下列说法不正确的是( )

A.A线表示Al3+的物质的量的变化
B.x表示NaOH的物质的量
C.C线表示Al(OH)3的物质的量的变化
D.D线表示Al(OH)3的物质的量的变化
【答案】D
【解析】
假定向含有1molAlCl3溶液中滴加NaOH溶液,首先发生反应Al3++3OH-=Al(OH)3↓,Al3+完全沉淀,消耗3molOH-,生成1molAl(OH)3,然后发生反应Al(OH)3+OH-=AlO2-+2H2O,沉淀完全溶解消耗1molOH-,生成1molAlO2-,前后两部分消耗的OH-为3:1;
假定向含有4molNaOH溶液中滴加AlCl3溶液,首先发生反应Al3++4OH-=AlO2-+2H2O,OH-完全反应消耗,1molAl3+生成1molAlO2-,然后发生反应Al3++3AlO2-+6H2O=4Al(OH)3↓,AlO2-完全反应,消耗![]() molAl3+,生成
molAl3+,生成![]() molAl(OH)3,前后两部分消耗的Al3+为1mol:
molAl(OH)3,前后两部分消耗的Al3+为1mol:![]() mol=3:1,由图象可知,A、B表示微粒关系,C、D表示微粒物质的量关系均为1:1可知,该图表示向AlCl3溶液中滴加NaOH溶液,据此结合选项解答。
mol=3:1,由图象可知,A、B表示微粒关系,C、D表示微粒物质的量关系均为1:1可知,该图表示向AlCl3溶液中滴加NaOH溶液,据此结合选项解答。
A. 由上述分析可知,首先发生反应Al3++3OH=Al(OH)3↓,溶液中铝离子物质的量减少,所以A线可以表示Al3+的物质的量的变化,故A正确;
B. 由上述分析可知,x可以表示NaOH的物质的量,故B正确;
C. 由上述分析可知,随反应进行Al(OH)3物质的量先增大,后减小,故B、C线可表示Al(OH)3的物质的量的变化,故C正确;
D. 由上述分析可知,Al(OH)3溶解时,AlO2的物质的量增大,所以D线表示AlO2的物质的量的变化,故D错误;
所以本题答案:D。


科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:则CH4的燃烧热为( )
![]() CH4(g)+O2(g)=
CH4(g)+O2(g)= ![]() CO2(g)+H2O(l) ΔH=-445.15 kJ·mol-1
CO2(g)+H2O(l) ΔH=-445.15 kJ·mol-1
CH4(g)+![]() O2(g)=CO(g)+2H2O(l) ΔH=-607.3 kJ·mol-1
O2(g)=CO(g)+2H2O(l) ΔH=-607.3 kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-802.3 kJ·mol-1
A.445.15 kJ·mol-1B.890.3 kJ·mol-1
C.607.3 kJ·mol-1D.802.3 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列生产、生活等实际应用,不能用勒夏特列原理解释的是( )
A.实验室中配制![]() 溶液时,应将
溶液时,应将![]() 固体溶解在少量浓盐酸中再加水稀释
固体溶解在少量浓盐酸中再加水稀释
B.合成氨工业中使用铁触媒做催化剂
C.饱和![]() 溶液滴入沸水中可制得氢氧化铁胶体
溶液滴入沸水中可制得氢氧化铁胶体
D.用![]() 制取无水
制取无水![]() 时需在
时需在![]() 气流中进行
气流中进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香草醛是一种食品添加剂,可由愈创木酚作原料合成,合成路线如下:

下列说法正确的是( )
A. 反应1→2属于加成反应,且生成的化合物2具有一个手性碳原子
B. 化合物2在一定条件下可发生消去反应
C. 检验制得的香草醛中是否混有化合物3,可用氯化铁溶液
D. 等物质的量四种化合物分别与足量NaOH反应,消耗NaOH物质的量之比为1:3:2:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组通过下列装置探究MnO2与FeCl3·6H2O能否反应产生Cl2,FeCl3的升华温度为315℃。

实验操作和现象:
操作 | 现象 |
点燃酒精灯,加热 | ⅰ.A中部分固体溶解,上方出现白雾 ⅱ.稍后,产生黄色气体,管壁附着黄色液滴 ⅲ.B中溶液变蓝 |
(1)现象ⅰ中的白雾是___。
(2)分析现象ⅱ,该小组探究黄色气体的成分,实验如下:
a.加热FeCl3·6H2O,产生白雾和黄色气体。
b.用KSCN溶液检验现象ⅱ和a中的黄色气体,溶液均变红。通过该实验说明现象ⅱ中黄色气体含有___。
(3)除了氯气可使B中溶液变蓝外,推测还可能的原因是:
①实验b检出的气体使之变蓝,反应的离子方程式是___。经实验证实推测成立。
②溶液变蓝的另外一种原因是:在酸性条件下,装置中的空气使之变蓝。通过进一步实验确认了这种可能性,其实验方案是___。
(4)为进一步确认黄色气体是否含有Cl2,小组提出两种方案,均证实了Cl2的存在。
方案1:在A、B间增加盛有某种试剂的洗气瓶C。
方案2:将B中KI淀粉溶液替换为NaBr溶液;检验Fe2+。
现象如下:
方案1 | B中溶液变为蓝色 |
方案2 | B中溶液呈浅橙红色,未检出Fe2+ |
①方案1的C中盛放的试剂是___(填字母)。
A.NaCl饱和溶液 B.NaOH溶液 C.NaClO溶液
②方案2中检验Fe2+的原因是___。
③综合方案1、2的现象,说明选择NaBr溶液的依据是___。
(5)将A中的产物分离得到Fe2O3和MnCl2,A中产生Cl2的化学方程式是:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛在航天、潜海和医疗方面应用广泛。以钛铁矿[主要成分为钛酸亚铁(FeTiO3),含少量Fe2O3]为原料制备钛的工艺流程如图所示。
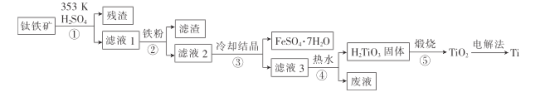
(1)步骤②、③、④中,均需进行的操作是_____________(填操作名称)。
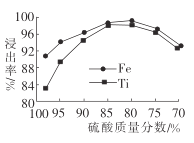
(2)滤液1中钛元素以TiO2+形式存在,步骤①中生成TiO2+的化学方程式为__________,硫酸质量分数对钛、铁浸出率的影响如图所示.据此判断,酸浸时所加硫酸的质量分数应为______(填范围)。.
(3)请结合离子方程式解释步骤④中加热水的原因:__________。
(4)电解法制备Ti的装置是以石墨为阳极,TiO2为阴极,熔融CaO为电解质。Ti在_______(填“阳极”或“阴极”)生成,____(填“能”或“不能”)将熔融CaO换成石灰乳。
(5)以绿矾为原料,可以制备重要工业原料氧化铁,基本流程如下:
![]()
①绿矾溶液中离子浓度由大到小的顺序为__________。
②FeCO3达到沉淀溶解平衡时,室温下测得溶液的pH为8,c(Fe2+ )=1.0×10-5 mol·L-1。所得FeCO3中_____(填“含”或“不含”)有Fe(OH)2。已知: {Ksp[Fe(OH)2]= 4.9×10-17}
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如图(金属单质E可由滤液C制取):

已知:Cu2O+2H+=Cu+Cu2++H2O。
(1)固体混合物B的成分是__。
(2)滤液A中铁元素的存在形式为__(填离子符号),生成该离子与Fe元素有关的离子反应方程式为___,___。
(3)在滤液C中通入过量CO2气体,除了CO2+OH-=HCO3-主要离子方程式有:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是

A. 常温常压下五种元素的单质中Z单质的沸点最高
B. Y、Z的阴离子电子层结构都与R原子相同
C. W的氢化物的热稳定性比X的氢化物的热稳定性高
D. Y元素的非金属性比W元素的非金属性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤和石油不仅是重要的矿物能源,更可以通过综合利用得到多种有机化工产品。
(一)乙烯是石油化工最重要的基础原料,请根据以下框图回答:
![]()
(1)乙烯分子的空间结构是_____________;C官能团名称是__________________。
(2)与乙烯和氢气的加成产物互为同系物的是_______(填写编号)。
a. C2H2 b. C6H6 c. C5H12 d. C2H6O
(3)A→B的化学方程式____________________________________。
(4)A+C→乙酸乙酯的化学方程式____________________________________。
(5) “乙烯→A”的反应类型是__________反应。下列物质在一定条件下都能与乙烯反应,其中反应类型与“乙烯→A”的不相同的是_____________(填序号)。
a.氢气 b.氯化氢 c.氧气 d.溴水
(6)实验室常用乙醇和浓硫酸共热制取乙烯,温度必须控制在_______________℃,加热时要使温度迅速上升至所需温度,其原因是____________________________________;实验时常在烧瓶中加入碎瓷片,目的是_______________________;实验室常用_________________法收集乙烯。
(二)煤焦油中可以分离出一种重要的液态烃——苯。
苯和液溴可以发生反应。根据下图装置回答:

(1)现代化学认为苯分子中的碳碳键是________________________________________。
(2)反应时A试管内须放些铁丝,铁丝的作用是__________________________,A试管中发生的反应的化学方程式是 __________________________________________。
(3)双球U型管里盛放的液体是CCl4,其作用是_________________________________。
(4)当B试管盛放的是_____________(填序号),看到的现象是__________________,就可以证明该反应是取代反应。
a.硝酸银溶液 b.石蕊溶液 c.氢氧化钠溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com