
| 成分 | 质量(g) | 摩尔质量(g·mol-1) |
| 蔗糖 | 50.0 | 342 |
| 硫酸钾 | 0.5 | 174 |
| 阿司匹林 | 0.4 | 180 |
| 高锰酸钾 | 0.5 | 158 |
| 硝酸银 | 0.2 | 170 |
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
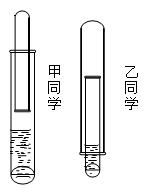
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
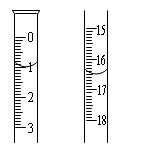
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 热制取乙烯。
热制取乙烯。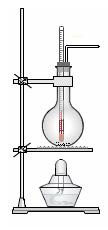
 插入反应溶液液面下,以便控制温度
插入反应溶液液面下,以便控制温度 可用可不用) 。
可用可不用) 。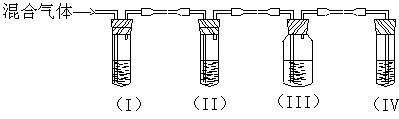
 ;II ;III ;IV 。
;II ;III ;IV 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
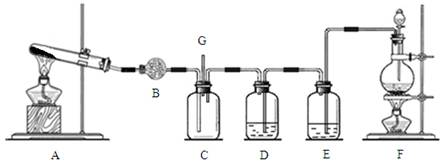
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.用蒸馏水洗涤烧杯及玻璃棒2-3次,洗涤液均注入容量瓶,振荡 |
| B.用托盘天平称量所需的Na2CO3·10H2O晶体,放入烧杯中,再加入少量水,用玻璃棒慢慢搅动,使其完全溶解 |
| C.将已冷却的Na2CO3溶液沿玻璃棒注入容量瓶中 |
| D.将容量瓶盖紧,振荡摇匀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在洁净的试管中加入1~2mLAgNO3溶液,再加入过量浓氨水振荡混合 |
| B.在洁净的试管中加入1~2mL浓氨水,再加入AgNO3溶液至过量 |
| C.在洁净的试管中加入1~2mL稀氨水,再逐滴加入2% AgNO3溶液至过量 |
| D.在洁净的试管中加入2% AgNO3溶液1~2mL,逐滴加入2%稀氨水至沉淀恰好溶解为止 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com