
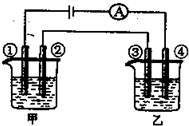
| A | B | C | D | |
| 甲 | KOH | H2SO4 | Na2SO4 | CuSO4 |
| 乙 | CuSO4 | AgNO3 | HCl | HNO3 |
| A.A | B.B | C.C | D.D |


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:阅读理解
| 时间/min浓度(mol/L) | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0?30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年天津市红桥区高三第一次模拟考试理综化学试卷(解析版) 题型:填空题
(1)臭氧可用于净化空气、饮用水消毒、处理工业废物和作为漂白剂。
①臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:
6Ag(s)+O3(g)=3Ag2O(s);△H=-235.8 kJ/mol。
己知:2 Ag2O(s)=4Ag(s)+O2(g);△H=+62.2kJ/mol,则O3转化为O2的热化学方程式为 ;②科学家P.Tatapudi等人首先使用在酸性条件下电解水的方法制得臭氧。臭氧在阳极周围的水中产生,阴极附近的氧气则生成过氧化氢,阴极电极反应式为 。
|
时间/min浓度(mol/L) |
NO |
N2 |
CO2 |
|
0 |
1.00 |
0 |
0 |
|
10 |
0.58 |
0.21 |
0.21 |
|
20 |
0.40 |
0·30 |
0.30 |
|
30 |
0.40 |
0.30 |
0.30 |
|
40 |
0.32 |
0.34 |
0.17 |
|
50 |
0.32 |
0.34 |
0.l7 |
(2)用活性炭还原法处理氮氧化物,有关反应为: C(s)+2NO(g) N2(g)+CO2(g)。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
①10 min~20 min以内v(CO2)表示的反应速率为
②根据表中数据,计算T1℃时该反应的平衡常数K= (保留两位小数);
③下列各项能作为判断该反应达到平衡状态的是 (填序号字母);
A.容器内压强保持不变
B.2v正(NO)=v逆(N2)
C.容器内CO2的体积分数不变
D.混合气体的密度保持不变
④30 min时改变某一条件,反应重新达到平衡,则改变的条件可能是 ;
⑤一定温度下,随着NO的起始浓度增大,则NO的平衡转化率 (填“增大”、“不变”或“减小”)。
查看答案和解析>>
科目:高中化学 来源:红桥区一模 题型:问答题
| 时间/min浓度(mol/L) | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0?30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.l7 |
查看答案和解析>>
科目:高中化学 来源:2013年天津市红桥区高考化学一模试卷(解析版) 题型:解答题
| 时间/min浓度(mol/L) | NO | N2 | CO2 |
| 1.00 | |||
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0?30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.l7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com