
铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应)。有研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。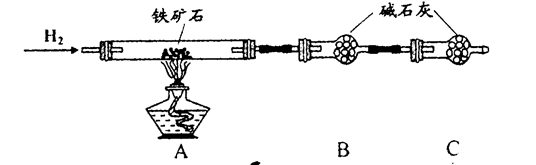
实验一:铁矿石中含氧量的测定
a.按上图组装仪器(夹持仪器均省略),检查装置的气密性;
b.将5.0g铁矿石放入硬质玻璃管中;
c.从左端导气管口处不断地缓缓通入H2,待C装置出口处对H2验纯后,点燃A处酒精灯;
d.充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却。
(1)装置C的作用为_______________________________________________________。
(2)测得反应后装置B增重1.35g,则铁矿石中氧的质量分数为______________________。
实验二:铁矿石中含铁量的测定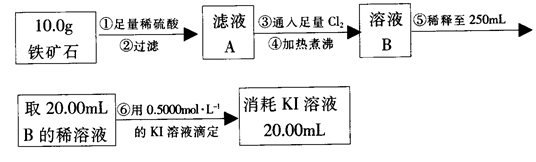
(3)步骤④中煮沸的目的是_____________________________________________。
(4)步骤⑤中用到的玻璃仪器有烧杯、胶头滴管、_________________________。
(5)下列有关步骤⑥的操作中说法不正确的是_______________________________。
a.滴定管用蒸馏水洗涤后再用待装液润洗
b.锥形瓶不需要用待测液润洗
c.因为碘水为黄色,所以滴定过程中不需加指示剂
d.滴定过程中可利用淀粉溶液作为指示剂
(6)铁矿石中铁的质量分数为______________________________________________。
实验结论:推算铁的氧化物的组成
(7)由实验一、二得出该铁矿石中铁的氧化物的化学式为____________________________。
(14分、每空2分)(1)防止空气中的水蒸气和CO2进入B中,影响测定结果 (2)24%
(3)除去溶液中溶解的过量的Cl2 (4)玻璃棒、250ml容量瓶(未答“250ml”不给分)
(5)cd (6)70% (7)Fe5O6
解析试题分析:(1)该实验中,氢气和氧化铁反应生成金属铁和水,根据固体质量的变化来计算铁的含量,B处的干燥管作用是吸收产生的水蒸气,所以C装置要防止空气中的水蒸气和CO2进入B中,影响测定结果。
(2)测的反应后装置B增重1.35g,根据反应FeyOx+H2→Fe+H2O可知,B中增加的质量就是反应中产生的水的质量。而水中的氧元素来自于矿石中,所以矿石中氧元素的质量分数是=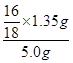 ×100%=24%。
×100%=24%。
(3)向铁矿石中加入硫酸,矿石溶解生成硫酸的铁盐或亚铁盐溶液,还存在过量的硫酸溶液。加入过量的氯气的目的是将溶液中的亚铁离子氧化生成铁离子。由于氯气是过量的,所以煮沸的作用是除去溶液中溶解的过量的Cl2。
(4)容量瓶是一种定容仪器,若是稀释到250mL,则需要的仪器是烧杯、玻璃棒、胶头滴管、250mL容量瓶。
(5)a.滴定管用蒸馏水洗涤后必须用标准液润洗,故a正确;b.锥形瓶不需要用待测液润洗,故b正确c.碘水为黄色,三价铁离子也是黄色溶液,滴定过程中需加指示剂,故c错误;d.滴定过程中,三价铁可以和碘离子发生反应生成亚铁离子和碘单质,碘单质遇到淀粉溶液显示蓝色,但是亚铁离子的绿色会产生干扰作用,因此不能用淀粉溶液做指示剂,故d错误,答案选cd。
(6)由于所取溶液(含Fe3+)的体积与消耗KI溶液的体积相等,因此结合方程式2Fe3++2I-=2Fe2++I2,知,c(Fe3+)=c(I-)=0.5mol/L,所以铁元素的百分含量为=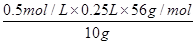 ×100%=70%。
×100%=70%。
(7)根据以上分析可知,矿石中铁和氧元素的个数之比是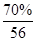 :
: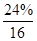 =5:6,所以化学式是Fe5O6。
=5:6,所以化学式是Fe5O6。
考点:考查物质含量的测定、实验方案设计与评价、物质的量浓度的配制、滴定实验操作以及物质化学式的确定等


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:实验题
某研究性学习小组,为了探究过氧化钠的强氧化性,设计了如图的实验装置。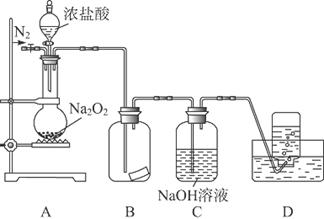
实验步骤及现象如下:
①检查装置气密性后,装入药品并连接仪器。
②缓慢通入一定量的N2后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,反应剧烈,产生黄绿色气体。
③一段时间后,将导管末端伸入集气瓶中收集气体。装置D中收集到能使带火星的木条复燃的无色气体。
④反应结束后,关闭分液漏斗的活塞,再通入一定量的N2,至装置中气体无色。
回答下列问题:
(1)装置B中的湿润的红色纸条褪色,证明A中反应有________(填化学式)生成。若B中改放湿润的淀粉KI试纸,仅凭试纸变蓝的现象不能证明上述结论,请用离子方程式说明原因________________。
(2)装置C的作用是_________________________________________________________。
(3)甲同学认为O2是Na2O2被盐酸中的HCl还原所得。乙同学认为此结论不正确,他可能的理由为①_________________________________________________________________;
②______ __。
(4)实验证明,Na2O2能与干燥的HCl反应,完成并配平该化学方程式。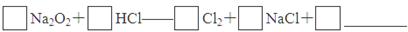
该反应________(填“能”或“不能”)用于实验室快速制取纯净的Cl2,理由是___________________________________________________________________________________________________________________________________(要求答出要点)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
铁是人体不可缺少的微量元素,硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂(每片b克)中铁元素的含量。实验步骤如下: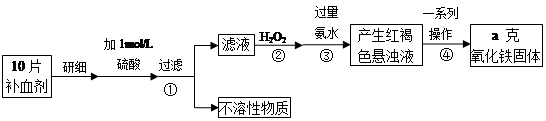
请回答下列问题:
(1)步骤②中H2O2的作用是使Fe2+完全被 (填“氧化”或“还原”)为 Fe3+.
(2)步骤③所得的红褐色悬浊液中除H2O2、氨水外主要还含 和 (填化学式).
(3)步骤④中一系列处理的操作步骤为 、洗涤、灼烧、冷却、称量.
(4)实验中用已经准确量取的浓硫酸配制100 mL 1 mol/L的硫酸溶液,则配制时用到的仪器除烧杯、玻璃棒,还有两种仪器是 .
(5)若实验无损耗,则每片补血剂含铁元素的质量分数为 .
(6)下列操作会导致所测定的铁元素含量偏高的是
A. 步骤③所加氨水量不足 B. 步骤④洗涤不充分 C. 步骤④灼烧不充分
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
氯化亚铁溶液中滴加硫氰化钾溶液,再滴加双氧水,立即出现血红色,后红色又褪去呈黄色并伴有气泡产生,针对该实验现象,某实验小组的同学进行了探究
一、现象分析
假设A:气泡是H2O2分解产生的O2
假设B:气泡是KSCN被氧化为N2、SO2、CO2等
假设C:红色褪去的原因是KSCN被氧化成了其它物质
二、实验探究
探究1
| 实验操作 | 实验现象 | 结论 |
| ①1mL 0.1mol/L的FeCl2溶液中加2滴KSCN溶液 | 溶液不变红 | Fe2+遇SCN-不变红 |
| ②向①的溶液中加3%的H2O21滴并振荡 | 立即出现血红色 振荡后不褪色 | 加入H2O2后溶液中 出现了 (离子符号) |
| ③向②的溶液中继续加H2O2溶液 | 溶液中出现大量气泡 血红色褪去 | |
| ④用带火星的木条检验③中的气体 | 木条复燃 | 则假设 成立 |
| 实验操作 | 实验现象 | 结论 |
| ①取2ml KSCN溶液向其中加入几滴BaCl2溶液和稀盐酸 | 无明显现象 | |
| ②向①所得的溶液中滴加3%的H2O2 | 溶液中出现白色沉淀并有少量气泡 | 白色沉淀为BaSO4 |
| ③将6%的H2O2溶液加入KSCN固体中,生成的气体依次通过品红溶液,酸性KMnO4溶液和澄清的石灰水 | | KSCN被H2O2氧化生成了SO2和CO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应)。某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。
Ⅰ.铁矿石中含氧量的测定;
① 按上图组装仪器,检查装置的气密性;
② 将5.0g铁矿石放入硬质玻璃管中,装置B、C中的药品都为碱石灰(详见图示,夹持仪器省略)
③ 从左端导气管口处不断地缓缓通入H2,待C装置出口处H2验纯后,点燃A处酒精灯
④ 充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却。
(1)装置C的作用为 。
(2)测的反应后装置B增重1.35g,则铁矿石中氧的百分含量为 。
Ⅱ.铁矿石中含铁量的测定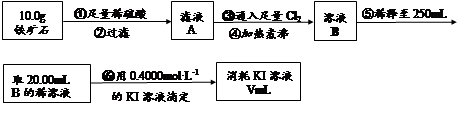
(3)步骤④中煮沸的作用是 。
(4)步骤⑤中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、 。
(5)下列有关步骤⑥的操作中说法正确的是 。
a.因为碘水为黄色,所以滴定过程中不需加指示剂
b.滴定过程中可利用淀粉溶液作为指示剂
c.滴定管用蒸馏水洗涤后可以直接装液
d.锥形瓶不需要用待测液润洗
e.滴定过程中,眼睛注视滴定管中液面变化
f.滴定结束后,30s内溶液不恢复原来的颜色再读数
(6)若滴定过程中消耗0.4000mol·L?1KI溶液25.00ml,则铁矿石中铁的百分含量为 。
Ⅲ.(7)由Ⅰ、Ⅱ可以推算出该铁矿石中铁的氧化物的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
铁黄是一种重要的颜料,化学式为Fe2O3·xH2O,广泛用于涂料、橡胶、塑料、文教用品等工业。实验室模拟工业利用硫酸渣(含Fe2O3及少量的CaO、MgO等)和黄铁矿粉(主要成分为FeS2)制备铁黄的流程如下:
(1)操作Ⅰ与操作Ⅱ中都用到玻璃棒,玻璃棒在两种操作中的作用分别是 、 。
(2)试剂a最好选用 (供选择使用的有:铝粉、空气、浓HNO3);其作用是 。
(3)上述步骤中需用到氨气。下列装置可用于实验室制氨气的是 (填序号)。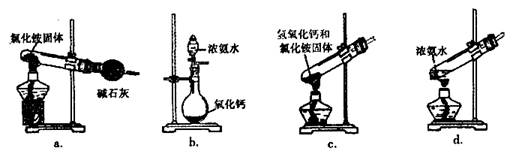
(4)检验溶液Z中含有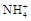 的方法是 。
的方法是 。
(5)查阅资料知,在不同温度下Fe2O3被CO还原,产物可能为Fe3O4、FeO或Fe,固体质量与反应温度的关系如下图所示。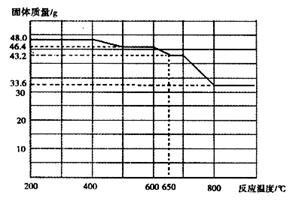
根据图象推断670℃时Fe2O3还原产物的化学式为 ,并设计一个简单的实验,证明该还原产物的成分(简述实验操作、现象和结论)。 。仪器自选。可供选择的试剂:稀H2SO4、稀盐酸、H2O2溶液、NaOH溶液、KSCN溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
SiO2、SO2和CO2都是酸性氧化物,它们的化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性。某兴趣小组用如图所示装置进行Mg与SO2反应的实验。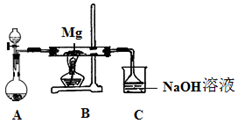
(1)选择制取SO2的合适试剂 (填编号)。
①浓HCl ②浓H2SO4 ③Na2SO3固体 ④CaSO3固体
(2)上述装置还可优化,优化的方法是 ,装置C中NaOH溶液的作用是 。
(3)甲同学推测Mg与SO2的反应与CO2相似,则该反应方程式为
;乙同学的推测是:2Mg+3SO2 2MgSO3+S;丙同学的推测是:3Mg+SO2
2MgSO3+S;丙同学的推测是:3Mg+SO2 2MgO+MgS,要验证甲、乙、丙三位同学的推测是否正确,丁同学作如下实验探究:
2MgO+MgS,要验证甲、乙、丙三位同学的推测是否正确,丁同学作如下实验探究:
已知:MgSO3和MgS都是微溶于水,能与盐酸发生复分解反应放出气体;H2S气体通入CuSO4溶液中出现黑色沉淀。
限选试剂:2mol/L HCl、2mol/L HNO3、蒸馏水、2mol/LNaOH、品红溶液、澄清石灰水、2mol/LCuSO4;仪器和用品自选。
| 序号 | 实验步骤 | 预期现象和结论 |
| ① | 取少量反应后所得固体于试管中 | |
| ② | 向试管中的固体慢慢滴加 , 试管口塞上带导管的单孔塞,并将导管通入盛有 的试管中。 | 若试管中的 , 则丙同学推测正确。 若试管中的固体未完全溶解,且 ,则乙同学推测正确。 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是
| A.氯水的颜色呈浅绿色,说明氯水中含有Cl2 |
| B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- |
| C.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ |
| D.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于二氧化硫的说法,正确的是
| A.能漂白某些物质,说明其有氧化性 |
| B.能使紫色石蕊试液变红,说明其水溶液呈酸性 |
| C.能用浓硫酸干燥,说明其不具有还原性 |
| D.能使溴水腿色,说明其具有漂白性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com