
【题目】前20号元素M、N、R、Q、Z的原子序数依次递增,M与Z、N与Q分别同主族,M、N形成的常见化合物有M2N、M2N2,由该5种元素组成的某结晶化合物X常用作净水剂。下列叙述错误的是( )
A.化合物X中含有离子键和共价键
B.简单离子半径由大到小的顺序为ZRQN
C.N、Q分别与Z形成化合物的水溶液均呈碱性
D.R、Q、Z的最高价氧化物的水化物间能相互反应
【答案】B
【解析】
由5种元素组成的某结晶化合物X常用作净水剂,X可能为明矾KAl(SO4)2![]() 12H2O,K与H、O与S同主族,H与O能形成H2O、H2O2,符合题意,故M、N、R、Q、Z分别为H、O、Al、S、K。
12H2O,K与H、O与S同主族,H与O能形成H2O、H2O2,符合题意,故M、N、R、Q、Z分别为H、O、Al、S、K。
A.综上分析,X为KAl(SO4)2![]() 12H2O,分子中既含钾离子、铝离子与硫酸根离子的离子键又含硫原子与氧原子、氢原子与氧原子的共价键,A正确;
12H2O,分子中既含钾离子、铝离子与硫酸根离子的离子键又含硫原子与氧原子、氢原子与氧原子的共价键,A正确;
B.离子电子层数越多半径越大,层数相同时,核电荷数越大半径越小,则N、R、Q、Z对应的离子半径由小到大的是S2->K+>O2->Al3+,应为QZNR,B错误;
C.N与Z形成化合物K2O、K2O2与水反应生成KOH,Q与Z形成的化合物为K2S,易水解使溶液均呈碱性,C正确;
D. R、Q、Z的最高价氧化物的水化物分别为氢氧化铝、硫酸、氢氧化钾,氢氧化铝具有两性,能与强酸、强碱反应,故硫酸与氢氧化钾均能和氢氧化铝反应,D正确;
答案选B。


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
【题目】下列说法或有关化学用语的表达正确的是
A.在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量
B.基态Fe原子的外围电子排布图为:![]()
C.因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大
D.某主族元素的电离能I1~I7数据如表所示(单位:kJ/mol),可推测该元素位于元素周期表第ⅣA族
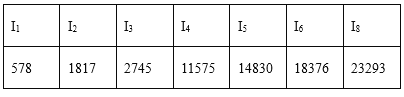
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两只锥形瓶中分别加入浓度均为l molL-1 的盐酸和NH4Cl溶液,将温度和pH 传感器与溶液相连,往瓶中同时加入过量的质量、形状均相同的镁条,实验结果如下图。关于该实验的下列说法,正确的是
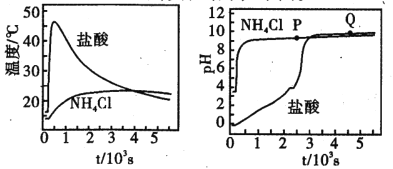
A.P点溶液:c(NH4+) + 2c(Mg2+) >c(Cl-)
B.反应剧烈程度:NH4Cl >HCl
C.Q点溶液显碱性是因为MgCl2发生水解
D.1000s后,镁与NH4Cl溶液反应停止
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯( NOCl) 是有机合成中的重要试剂,为黄色气体或红褐色液体(熔点- 64. 5℃,沸点-5.5℃),具有刺鼻恶臭味,遇水和潮气水解,有多种方法制备。
(1)方法一:将5 g 经300℃下干燥了 3h 并研细的 KCl 粉末装入 50 mL 带有接头及抽真空用活塞的玻璃容器内。将容器尽量减压,在减压下通入0. 002 mol NO2。反应 12 ~ 36 min 即可完成,NO2红棕色消失 ,出现黄色亚硝酰氯,同时还得到一种盐。写出亚硝酰氯的电子式________,该方法制备NOCl的化学方程式为_________________,氯化钾需要“干燥”的原因是_______________。
(2)方法二:实验室可用如图装置制备亚硝酰氯(NOCl),检验装置气密性并装入药品打开 K2,然后再打开___________(填“K1 ”或"“K3 ”) 通入一段时间气体,其目的为______,然后进行其他操作,当 Z 有一定量液体生成时,停止实验。写出X 装置中反应的离子方程式_____________________ 。

(3)测定产品纯度:取(2)中w g Z 中液态产品溶于蒸馏水,配制成250 ml 溶液;用酸式滴定管准确量取25. 00mL 所配溶液于锥形瓶中,滴加几滴 K2CrO4溶液作指示剂,用滴定管盛装 c mol·L-1 AgNO3标准溶液滴定至终点,消耗标准溶液体积为V mL。[已知:Ksp( AgCl ) =1.56 ×10-10 ,Ksp(Ag2CrO4)=1×10-12,Ag2CrO4为砖红色固体,忽略杂质参与反应]
①盛装AgNO3 标准溶液的滴定管是____(填“酸式”或“碱式”)棕色滴定管;判断达到滴定终点的方法是_____________________。
②该产品纯度为_____________(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,科学家开发出一种低成本光伏材料——蜂窝状石墨烯。生产原理是:Na2O+2CO![]() Na2CO3+C(石量烯),然后除去Na2CO3,即可制得蜂窝状石墨烯。下列说法不正确的是
Na2CO3+C(石量烯),然后除去Na2CO3,即可制得蜂窝状石墨烯。下列说法不正确的是
A. 该生产石墨烯的反应属于氧化还原反应
B. 石墨烯与金刚石互为同素异形体
C. Na2O属于碱性氧化物,CO属于酸性氧化物,Na2CO3属于盐
D. 自然界中碳元素有游离态和化合态两种存在形式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究团队在优化催化剂的基础上,通过调节电极的孔道和疏水性增加CO的扩散速率,实现了高选择性将CO电解还原制备乙烯,如图所示。下列叙述错误的是( )

A.碳纸/聚四氟乙烯电极为阴极
B.聚四氟乙烯的作用是吸附并增加CO的浓度
C.为了维持电解的效率,离子交换膜应为阳离子交换膜
D.碳纸上生成C2H4的电极反应式为:2CO+6H2O+8e-=C2H4+8OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2作为绿色氧化剂被应用于废水处理、造纸和化学合成等行业。
(1)已知:H2(g)+![]() O2(g)=H2O(l) ΔH1=-285.8kJ·mol-1
O2(g)=H2O(l) ΔH1=-285.8kJ·mol-1
H2(g)+O2(g)=H2O2(l) ΔH2=-135.8kJ·mol-1
①H2(g)与O2(g)的反应中,在热力学上更有利的产物是__,原因是__。
②常温下,H2O2分解的热化学方程式为__。
(2)我国科学家使用Ag9团簇作催化剂,研究H2O2的合成。各步骤的活化能和反应热,如表所示,利用计算机模拟反应历程如图所示(TS表示过渡态,表示被催化剂吸附的物种)。
Ag9团簇上生成H2O2的活化能Ea和反应热![]()
步骤 | 过渡态 | Ea/kJ |
| |
A | Ag9 | TS1 | 74.1 | +68.7 |
B | H—Ag9 | TS2 | 108.7 | -27.2 |
C | H—Ag9—H+ O2 | TS3 | 78.4 | -75.4 |
D | HOO | TS4 | 124.7 | +31.3 |

①通过降低步骤___(填字母)的能垒(活化能),可以较大幅度提高合成反应的速率。
②反应历程中2到3断裂的化学键为___(填序号)。
A.O2中的氧氧键 B.H2中的氢氢键 C.Ag9OOH中的氧氢键
(3)利用阴阳极同步放电产生H2O2和过硫酸铵[(NH4)2S2O8]的原理如图所示。阳极上放电的离子是___,阴极的电极反应式为___。
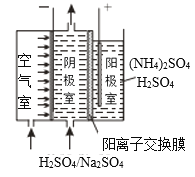
(4)常温下,H2O2分解速率方程v=0.0625·c(H2O2)mg·L-1·s-1,c(H2O2)随时间变化如下表:
C(H2O2) (mg | 10000.0 | 8000.0 | 4000.0 | 2000.0 | 1000.0 |
分解时间(s) | 0 | 7 | 23 | 39 | 55 |
①当c(H2O2)=8000.0mg·L-1时,v=__mg·L-1·s-1;
②当c(H2O2)降为5000.0mg·L-1时,分解时间为___s。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(DME)被誉为“21世纪的清洁燃料”。合成气(主要成分为CO、CO2和H2)是重要的化工原料,可利用合成气在催化剂存在下直接制备二甲醚(CH3OCH3)。
已知:① CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.0kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.0kJ·mol-1
② CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2=+41.1 kJ·mol-1
CO(g)+H2O(g) △H2=+41.1 kJ·mol-1
③ 2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H3=-24.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H3=-24.5 kJ·mol-1
(1)工业上用CO2和H2在一定条件下反应直接制备二甲醚,主反应为:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
①要使该反应速率和产率都增大,应该采取的措施是__________________________________;。
②一定条件下,上述主反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是__________(填标号)。
a.逆反应速率先增大后减小 b.H2的转化率增大
c.反应物的体积百分含量减小 d.容器中的![]() 变小
变小
③在某压强下,制备二甲醚的反应在不同温度、不同投料比时CO2的转化率如图(a)所示。T1温度下,将6molCO2和12molH2充入10L的密闭容器中, 5 min后反应达到平衡状态,则05 min内的平均反应速率υ(CH3OCH3)=__________;KA、 KB、 KC三者之间的大小关系为___________。
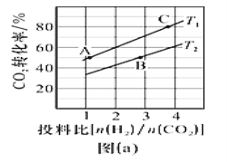

(2)在适当条件下由CO和H2直接制备二甲醚,另一产物为水蒸气。
①该反应的热化学方程式是_______________________________。
②CO的转化率、二甲醚的产率与反应温度的关系如图(b)所示,请解释290℃后升高温度,CH3OCH3产率逐渐走低的原因可能是________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com