
| A£®Ķ¬ĪĀ¶ČĶ¬ĪļÖŹµÄĮæÅØ¶ČŹ±£¬HF±ČHCNŅ×µēĄė£¬ŌņNaFČÜŅŗµÄpH±ČNaCNČÜŅŗ“ó |
| B£®0.2 mol”¤L-1NH4ClŗĶ0.1 mol”¤L-1NaOHČÜŅŗµČĢå»ż»ģŗĻŗó£ŗ c(  )£¾c(Cl-)£¾c(Na+)£¾c(OH-)£¾c(H+) )£¾c(Cl-)£¾c(Na+)£¾c(OH-)£¾c(H+) |
| C£®ĪļÖŹµÄĮæÅضČĻąµČµÄH2SŗĶNaHS»ģŗĻČÜŅŗÖŠ£ŗ c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-) |
D£®Ķ¬ÅØ¶ČµÄĻĀĮŠČÜŅŗÖŠ£¬¢Ł(NH4)2SO4”¢¢ŚNH4Cl”¢¢ŪCH3COONH4”¢¢ÜNH3”¤H2O£»c( )Óɓ󵽊”µÄĖ³ŠņŹĒ£ŗ¢Ł£¾¢Ś£¾¢Ū£¾¢Ü )Óɓ󵽊”µÄĖ³ŠņŹĒ£ŗ¢Ł£¾¢Ś£¾¢Ū£¾¢Ü |
 )£»ÓɵēŗÉŹŲŗćæÉÖŖ£¬CĻīÓ¦ĪŖc(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-)”£
)£»ÓɵēŗÉŹŲŗćæÉÖŖ£¬CĻīÓ¦ĪŖc(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-)”£

 Š”ѧѧĻ°ŗĆ°ļŹÖĻµĮŠ“š°ø
Š”ѧѧĻ°ŗĆ°ļŹÖĻµĮŠ“š°ø Š”ѧĶ¬²½ČżĮ·ŗĖŠÄĆܾķĻµĮŠ“š°ø
Š”ѧĶ¬²½ČżĮ·ŗĖŠÄĆܾķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®NaHCO3ČÜŅŗÖŠ£ŗc(OH£)+c(HCO3£)+2c(CO32£)=c(Na+)+c(H+)+2c(H2CO3) |
| B£®°±Ė®ÓėNH4ClµÄ»ģŗĻČÜŅŗÖŠ£ŗc(NH4+)>c(Cl£) |
| C£®Ļņ“×ĖįÄĘČÜŅŗÖŠ¼ÓČėŹŹĮæ“×ĖįµĆµ½µÄĖįŠŌ»ģŗĻČÜŅŗ£ŗ c(Na+)>c(CH3COO£)>c(H+)>c(OH£) |
| D£®ĻņĻõĖįÄĘČÜŅŗÖŠµĪ¼ÓĒāŃõ»Æ¼ŲČÜŅŗµĆµ½µÄpH=13µÄ»ģŗĻČÜŅŗ£ŗc(Na+)=c(NO3£) |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®Na2S | B£®Na3PO4 | C£®Na2CO3 | D£®AlCl3 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
A£® +H2O +H2O NH3”¤H2O+H+ NH3”¤H2O+H+ |
B£®Al3++3H2O Al£ØOH£©3+3H+ Al£ØOH£©3+3H+ |
C£® +2H2O +2H2O Al£ØOH£©3+OH- Al£ØOH£©3+OH- |
D£® +H2O +H2O H3O++ H3O++ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
 ŗĶCl-ĖÄÖÖĄė×Ó£¬Ä³Ķ¬Ń§ĶĘ²āĘäĄė×ÓÅØ¶Č“óŠ”Ė³ŠņÓŠČēĻĀĖÄÖÖ¹ŲĻµ£ŗ
ŗĶCl-ĖÄÖÖĄė×Ó£¬Ä³Ķ¬Ń§ĶĘ²āĘäĄė×ÓÅØ¶Č“óŠ”Ė³ŠņÓŠČēĻĀĖÄÖÖ¹ŲĻµ£ŗ )£¾c(H£«)£¾c(OH-)
)£¾c(H£«)£¾c(OH-) )£¾c(OH-)£¾c(H£«)
)£¾c(OH-)£¾c(H£«) )£¾c(Cl-)£¾c(OH-)£¾c(H£«)
)£¾c(Cl-)£¾c(OH-)£¾c(H£«) )£¾c(OH-)
)£¾c(OH-)²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
A£®NaHCO3µēĄė£ŗNaHCO3====Na++H++ |
B£®H3PO4µēĄė£ŗH3PO4====3H++ |
C£® Ė®½ā£ŗ Ė®½ā£ŗ +H2O +H2O NH3”¤H2O+H+ NH3”¤H2O+H+ |
D£® Ė®½ā£ŗ Ė®½ā£ŗ +H2O +H2O H2CO3+2OH- H2CO3+2OH- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
A£® ”¢Na+”¢Cl-”¢OH- ”¢Na+”¢Cl-”¢OH- | B£®Al3+”¢Na+”¢ ”¢ ”¢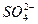 |
C£®H+”¢Fe2+”¢ ”¢Cl- ”¢Cl- | D£® ”¢K+”¢ ”¢K+”¢ ”¢Al3+ ”¢Al3+ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®pHĻąµČµÄCH3COONa”¢NaClO”¢NaHCO3ČżÖÖČÜŅŗ£ŗ c(CH3COONa) > c(NaClO) > c (NaHCO3) |
| B£®Na2CO3ČÜŅŗ£ŗc£ØOH££©”Ŗc£ØH£«£©£½c£ØHCO3££©+ c£ØH2CO3£© |
| C£®µČÅØ¶ČµÄNaClO”¢NaHCO3»ģŗĻČÜŅŗÖŠ£ŗ c£ØHClO£©+c£ØClO££©=c£ØHCO3££©+ c£ØH2CO3£© |
| D£®0.1 mol”¤L-1µÄKHAČÜŅŗ£¬ĘäpH£½10£ŗc(HA£)> c(OH£)> c(H£«)> c(A2£) |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®Na2CO3ČÜŅŗÖŠ£¬2c(Na£«)£½c(CO32£)£«c(HCO3£)£«c(H2CO3) |
| B£®NaBČÜŅŗµÄpH£½8£¬c(Na£«)£c(B£)£½9.9”Į10£7mol/L |
| C£®pHĻąµČµÄ¢ŁNH4Cl”¢¢Ś(NH4)2SO4”¢¢ŪNH4HSO4ČżÖÖČÜŅŗÖŠ£¬c(NH4£«)“óŠ”Ė³Šņ ¢Ł£¾¢Ś£¾¢Ū |
| D£®10mL pH£½12µÄĒāŃõ»ÆÄĘČÜŅŗÖŠ¼ÓČėpH£½2µÄHAÖĮpHøÕŗƵČÓŚ7£¬ĖłµĆČÜŅŗĢå»żV(×Ü)”Ż20mL |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com