
| 265.652kJ |
| 0.4 |
| 1 |
| 2 |


 �Ƹ������������ϵ�д�
�Ƹ������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��2009��1��11�գ�������Ȩ��֯--��Ȩ�۲������䱨����ָ����ɫ���ڼ�ɳ�˿ڳ��ܵ���ʹ����Υ������������֯�ڱ�����ָ�����Ծ��ں�ը���ڻ���ɳ����ʱʹ���˰���ը��������˵������ȷ���ǣ�������
��2009��1��11�գ�������Ȩ��֯--��Ȩ�۲������䱨����ָ����ɫ���ڼ�ɳ�˿ڳ��ܵ���ʹ����Υ������������֯�ڱ�����ָ�����Ծ��ں�ը���ڻ���ɳ����ʱʹ���˰���ը��������˵������ȷ���ǣ�������| A�������Ż��ͣ��ڿ����п���ȼ |
| B�����ס�����Ϊͬ�������� |
| C��31 g��������P-P��1.5 mol |
| D����֪P4�����ף�+3O2��g���T2P2O3��s����H=-Q kJ?mol-1�������ȼ����ΪQ kJ?mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������þ���������²��� |
| B����ͥ�õ����������ü�ˮϴ�ӣ�Ҳ���������������ʳ�� |
| C�������£���Ƭ����Ũ�����з������ҷ�Ӧ |
| D��þ���������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���������ᷴӦ |
| B��C��CO2���� |
| C��̼��Ƶķֽ� |
| D��Ba��OH��2?8H2O������NH4Cl���巴Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��ͨ����ͬ����Ԫ�صĵ�һ�����ܢ�A���Ԫ����� |
| B������Ԫ�ص�ԭ���γɵ�ԭ������ʱ�Ļ��ϼ�������������������� |
| C���ڢ�A����A��Ԫ�ص�ԭ�ӣ���뾶Խ��һ������Խ�� |
| D����ͬһ�����У����϶��µ�һ��������С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����Mg��HCO2��3��Һ�еμӹ�����NaOH��Һ�����ӷ���ʽ��Mg2++2HCO3-+2OH-�TMgCO3��+CO32-+2H2O | ||||||||||
| B����NH4Al��SO4��2��Һ�е���Ba��OH��2��Һǡ��ʹSO42-��ȫ���������ӷ���ʽ��2Ba2++NH4++Al3++2SO42-+4OH-�TAl��OH��3��+NH3?H2O+2BaSO4�� | ||||||||||
| C����ϡ�����ȥͭ�̵����ӷ���ʽ��4H++Cu2��OH��2CO3=2Cu2++CO2��+3H2O | ||||||||||
D����֪��
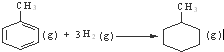 �ġ�HΪ-384 kJ?mol-1 �ġ�HΪ-384 kJ?mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ̼��Ũ���Ṳ�Ȳ���������X��ͭ��Ũ���ᷴӦ����������Yͬʱͨ��ʢ�������Ȼ�����Һ��ϴ��ƿ�У���ͼ��ʾ���������й�˵����ȷ���ǣ�������
̼��Ũ���Ṳ�Ȳ���������X��ͭ��Ũ���ᷴӦ����������Yͬʱͨ��ʢ�������Ȼ�����Һ��ϴ��ƿ�У���ͼ��ʾ���������й�˵����ȷ���ǣ�������| A��ϴ��ƿ�в����ij�����̼�ᱵ |
| B��ϴ��ƿ�в����ij��������ᱵ |
| C����Z���ܳ�����������������̼ |
| D��ϴ��ƿ�в����ij�����̼�ᱵ�����ᱵ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��SO2��S |
| B��Na2SO3��SO2 |
| C��Na��Na+ |
| D��I2��I- |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com