
相同温度下,两种弱酸HA、HB的电离平衡常数Ka(HA)>Ka(HB)。下列有关说法正确的是
A.浓度均为0.1 mol·L-1的HA、HB溶液中,其溶液的pH大小为:pH(HA)>pH(HB)
B.浓度均为0.1 mol·L-1的NaA、NaB溶液中,其溶液的pH大小为:pH(NaA)>pH(NaB)
C.等体积pH相同的HA、HB溶液,分别加入等浓度的NaOH溶液,恰好完全反应消耗的NaOH溶液体积HA比HB多
D.在0.1 mol·L-1NaA溶液中各离子浓度关系为:c(Na+)>c(A一)>c(OH一)>c(H+)
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源:2016届甘肃省张掖市高三上第一次诊断考试理综化学试卷(解析版) 题型:实验题
氯离子插层镁铝水滑石[Mg2Al(OH)6Cl·xH2O]是一种新型离子交换材料,其在高温下完全分解为MgO、Al2O3、HCl和水蒸气,冷却玻管B能降低气体的温度,但不能液化水蒸气。现用下图装置进行实验确定其化学式(固定装置略去)。
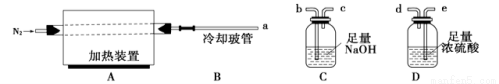
(1)Mg2Al(OH)6Cl·xH2O热分解的化学方程式为 。
(2)若只通过测定装置C、D的增重来确定x,则装置的连接顺序为 (按气流方向,用接口字母表示),其中C的作用是 。装置连接后,首先要进行的操作是 。
(3)加热前先通N2排尽装置中的空气,称取C、D的初始质量后,加热过程中持续通入N2的作用是 ,停止加热后的冷却过程中仍要持续通入N2的作用是 _。
(4)完全分解后测得C增重3.65 g、D增重9.90 g,则x= 。若取消冷却玻管B后进行实验,测定的x值将 (填“偏高”或“偏低”)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一上12月月考化学试卷(解析版) 题型:选择题
下列离子反应方程式正确的是
A.硫酸铝与氨水反应:Al3++3OH-=Al(OH)3↓
B.醋酸溶解鸡蛋壳:CaCO3+2H+=Ca2++H2O+CO2↑
C.在NaHCO3溶液中滴入少量澄清石灰水Ca2++OH-+HCO3-=CaCO3↓+H2O
D.在NaHSO4溶液中滴入Ba(OH)2溶液至溶液呈中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二上12月月考化学试卷(解析版) 题型:选择题
草酸(H2C2O4)是二元中强酸,草酸氢钠(NaHC2O4)溶液显酸性。常温下,向10 mL 0.01 mol•L-1 NaHC2O4溶液中滴加0.01 mol•L-1 NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
A.V(NaOH)=0时,c(H+)=1×10-2 mol•L-1
B.V(NaOH)<10 mL时,不可能存在c(Na+)=2c(C2O42-)+c(HC2O4-)
C.V(NaOH)=10 mL时,c(H+)=1×10-7 mol/L
D.V(NaOH)>10 mL时,c(Na+)>c(C2O42-)>c(HC2O4-)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一上第三次段考化学试卷(解析版) 题型:填空题
某二元弱酸(简写为H2A)溶液,按下式发生一级和二级电离:
H2A H++HA- HA-
H++HA- HA- H++A2-
H++A2-
已知相同浓度时的电离度α(H2A)>α(HA-)(α表示弱电解质的电离程度),设有下列四种溶液:
A.0.01 mol·L-1的H2A溶液
B.0.01 mol·L-1的NaHA溶液
C.0.02 mol·L-1的HCl与0.04 mol·L-1的NaHA溶液等体积混合液
D.0.02 mol·L-1的NaOH与0.02 mol·L-1的NaHA溶液等体积混合液
据此,填写下列空白(填代号):
(1)c(H+)最大的是________,最小的是________。
(2)c(H2A)最大的是________,最小的是________。
(3)c(A2-)最大的是________,最小的是________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一上第三次段考化学试卷(解析版) 题型:选择题
在一定条件下,向一体积为2L的恒容密闭容器中充入2mol A,1mol B,发生如下反应:
2A(g)+B (? ) 3C(g) △H=-QkJ/mol(Q>0)。经过60s达到平衡,测得B物质的量为0.2mol,下列对该平衡的叙述正确的
3C(g) △H=-QkJ/mol(Q>0)。经过60s达到平衡,测得B物质的量为0.2mol,下列对该平衡的叙述正确的
A.用C的浓度变化表示该反应速率为2.4mol/(L·min)
B.若使容器变为1L,则C的物质的量一定增大
C.达到平衡,测得放出热量为x kJ,则x=Q
D.若向容器再充入1mol C,重新达平衡,A的体积分数保持不变,则B为气态
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省高二上12月月考化学试卷(解析版) 题型:选择题
用右图所示装置去含CN-,Cl-废水中的CN-时,控制溶液PH为9-10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是
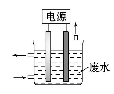
A.石墨作阳极,铁作阴极
B.阳极的电极反应式:Cl-+2OH--2e-=ClO-+H2O
C.阴极的电极反应式:2H2O+2e-=H2↑+2OH-
D.除去CN-的反应:2 CN-+5ClO-+2H+=N2↑+2CO2↑+5Cl-+H2O
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏唐徕回民中学高二上10月月考化学卷(解析版) 题型:填空题
能源是人类生存和发展的重要支柱。研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义。已知下列热化学方程式:
① 2H2(g)+O2(g)=2H2O(l) △H =-570kJ/mol ;
② H2(g)+1/2O2(g)=H2O(g) △H =-242kJ/mol ;
③ C(s)+1/2O2(g)=CO (g) △H = —110.5kJ/moL ;
④ C(s)+O2(g)=CO2(g) △H = —393.5kJ/moL;
⑤ CO2(g) +2H2O(g)=2CH4(g) +2 O2(g) △H = +890kJ/moL
回答下列问题:
(1)上述反应中属于燃烧热的热化学方程式的是 。
(2)H2的燃烧热为 。
(3)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然难直接测定,但可通过间接的方法求得。试写出碳与水蒸气反应的热化学方程式_ ;该反应的熵△S 0 (选填“>”、“=”、“<”);已知自由能△HG可推知该反应在______条件下可自发进行。
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上第二次模拟化学试卷(解析版) 题型:选择题
下列有关溶液的说法正确的是
A.要配制浓度为0.25mol·L-1的NaOH溶液480mL,应称量4.8g NaOH在250mL的烧杯中溶解,冷却,再转移到500mL容量瓶中,洗涤、转移、定容
B.配制NaOH溶液,在烧杯中溶解NaOH后未冷却至室温就转移到容量瓶中,溶液浓度偏低
C.配制一定物质的量浓度的溶液定容时,俯视刻度线导致所配浓度偏高
D.配制20g密度为ρg·cm-3的Ca(NO3)2溶液中含有2g Ca(NO3)2,则溶液中NO3-的物质的量浓度为5ρ/41mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com