
| A. | 反应A(g)?2B(g)△H,若正反应的活化能为Ea kJ/mol,逆反应的活化能为Eb kJ/mol,则△H=-( Ea-Eb)kJ/mol | |
| B. | 常温下,pH相同的NaOH溶液和Ba(OH)2溶液中,水的电离程度相同 | |
| C. | 某温度氯化钠在水中的溶解度是20 g,该温度饱和氯化钠溶液的质量分数为20% | |
| D. | 将浓度为0.1 mol/L HF溶液加水不断稀释过程中,电离平衡常数Ka(HF)保持不变,$\frac{c({F}^{-})}{c({H}^{+})}$始终保持增大 |
分析 A.反应A(g)?2B(g),若正反应的活化能为Ea kJ•mol-1,逆反应的活化能为Eb kJ•mol-1,反应的焓变等于正逆反应活化能之差;
B.常温下,同浓度的氢离子和氢氧根离子对水的电离抑制程度相等;
C.某温度下,100g水中溶解氯化钠的最大质量即是其溶解度;
D.弱酸加水稀释,其电离度增大,电离平衡常数不变,氟离子和氢离子物质的量同等程度的增大.
解答 解:A.逆反应的活化能=正反应的活化能+反应的焓变,所以△H=逆反应的活化能-正反应的活化能=(Ea-Eb)kJ•mol-1,故A错误;
B.常温下,同浓度的氢离子和氢氧根离子对水的电离抑制程度相等,而pH相同的NaOH溶液和Ba(OH)2溶液说明氢氧根离子浓度相等,所以水的电离程度相同,故B正确;
C.饱和溶液的质量分数和溶解度之间的关系:$\frac{S}{100+S}$×100%=$\frac{20}{20+100}$×100%,该温度下的饱和氯化钠溶液的溶质质量分数小于20%,故C错误;
D.将浓度为0.1 mol•L-1 HF溶液加水不断稀释过程中,电离度增大,Ka(HF)保持不变,氟离子浓度和氢离子浓度比值基本不变,故D错误;
故选B.
点评 本题综合考查反应焓变的计算、水的电离程度、饱和溶液溶质质量分数和溶解度之间的关系、弱电解质的电离平衡的知识,难度中等.


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
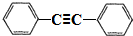 ,以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如下:
,以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如下: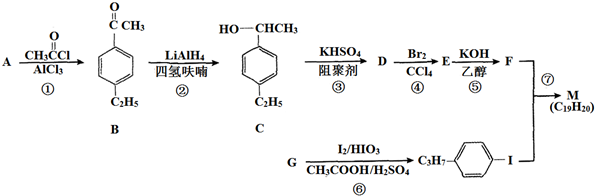
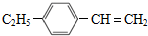 ,分子中最多有10个碳原子共平面,F结构中的官能团名称是碳碳三键;
,分子中最多有10个碳原子共平面,F结构中的官能团名称是碳碳三键;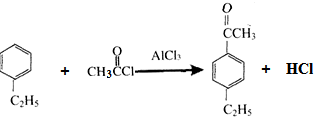 ,④的反应类型是加成反应;
,④的反应类型是加成反应;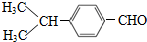 (写结构简式);
(写结构简式); 的合成路线
的合成路线 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾可作净水剂:Al3++3H2O=Al(OH)3↓+3H+ | |
| B. | 盛装NaOH溶液的试剂瓶不用玻璃塞:SiO2+2NaOH=Na2SiO3+H2O | |
| C. | NaHCO3溶液中加入少量Ca(OH)2溶液,产生白色沉淀:HCO3-+Ca2++OH-=CaCO3↓+H2O | |
| D. | 电解NaCl溶液,阴极有无色气体逸出,其电极反应式为:2Cl--2e-=Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
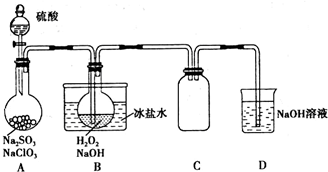
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4 L O2和O3的混合气中氧原子数为0.2NA | |
| B. | 标准状况下,22.4 L苯的分子数为NA | |
| C. | 46 g乙醇中含有的共价键总数为8 NA | |
| D. | 1 L 0.1 mol•L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


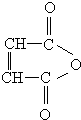 .
.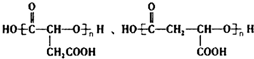 .
.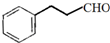 )与F的相对分子质量相同,其中满足下列条件的X的同分异构体有14种(含X本身).
)与F的相对分子质量相同,其中满足下列条件的X的同分异构体有14种(含X本身). 的最简合成线路.
的最简合成线路.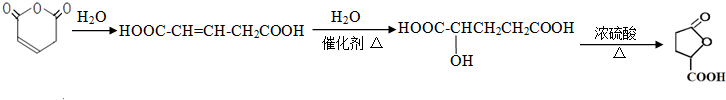 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| A | A元素原子核外只有三个能级,且每个能级上含有相等的电子数 |
| B | 是空气中含量最丰富的元素 |
| C | 短周期元素中,C的金属性最强 |
| D | 基态原子第三能层上有7种运动状态不同的电子 |
| E | 一种核素的质量数为63,中子数为34 |
| F | 最外层电子数为次外层的3倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
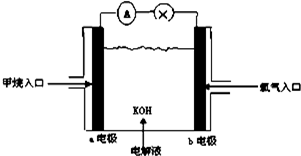
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com