
| 充电 |
| 放电 |
| O | 2- 8 |
| O | 2- 8 |
| O | 2- 4 |


 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:阅读理解
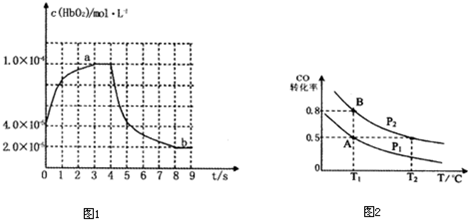
| 1 |
| 10000 |
| 1 |
| 10000 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
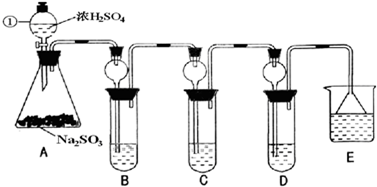
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省济宁市高三上学期期末考试化学试卷(解析版) 题型:填空题
研究物质间的氧化还原反应有重要的意义。
(1)一定条件下Fe(OH)3与KClO在KOH溶液中反应可制得K2FeO4,其中反应的氧化剂是___________;生成0.5mol K2FeO4转移电子的物质的量____________mol。
(2)高铁电池是一种新型二次电池,电解液为碱溶液,其反应式为:
3Zn(OH)2+2Fe(OH)3+4KOH 3Zn+2K2FeO4+8H2O
3Zn+2K2FeO4+8H2O
放电时,电池的负极反应式为____________。充电时电解液的pH____________(填“增大”“不变”或“减小”)
(3)H2O2是一种绿色氧化剂。工业制备H2O2的原理如下:
①电解池总反应:2S2O42−+2H+═S2O82-+H2↑
②电解生成的S2O82-水解:S2O82-+2H2O═H2O2+2H++SO42−
电解池中阴极反应式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 3Zn+2K2FeO4+8H2O
3Zn+2K2FeO4+8H2O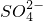 +2H+═S2
+2H+═S2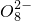 +H2↑
+H2↑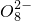 +2H2O═H2O2+2H++S
+2H2O═H2O2+2H++S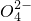 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com