
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015四川省邛崃市高一下学期第一次月考化学试卷(解析版) 题型:选择题
下列离子中,所带电荷数与该离子的核外电子层数相等的是
A.Al3+ B.Mg2+ C.Be2+ D.H+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东茂名市高三第二次高考模拟考试理综化学试卷(解析版) 题型:填空题
(16分)由有机物Ⅰ合成Ⅳ(香豆素)的合成路线如下:
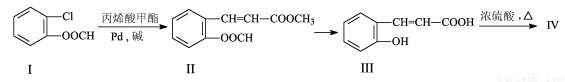
回答下列问题:
(1)写出分子式:丙烯酸甲酯____________________;
(2)写出反应类型:Ⅰ→Ⅱ ;若要Ⅱ→Ⅲ的反应完全,则Ⅱ→Ⅲ 反应需要的条件是 ;
(3)已知化合物Ⅳ的相对分子质量为146,写出结构简式:Ⅳ ;
(4)化合物V是Ⅲ的一种同分异构体,V有如下特征:分子中除苯环外,无其它环状结构;在核磁共振氢谱图中,有四个吸收峰;能发生银镜反应;1 mol V最多能与2mol的NaOH反应。V的结构简式为________________;
(5)根据已有知识并模仿香豆素合成路线的相关反应,试写出以氯苯和丙烯(CH2=CH-CH3)为原料,合成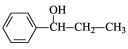 的化学方程式 (无机试剂任选)。
的化学方程式 (无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南京市、盐城市高三第二次模拟考试化学试卷(解析版) 题型:选择题
下列溶液中有关物质的量浓度关系正确的是
A.0.1 mol·L-1NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
B.0.1 mol·L-1NaHCO3溶液与0.1 mol·L-1NaOH溶液等体积混合:c(Na+)=2c(CO32-)+c(HCO3-)+2c(H2CO3)
C.0.1 mol·L-1NaHCO3溶液与0.2 mol·L-1NaOH溶液等体积混合:c(Na+)>c(OH-)>0.05 mol·L-1>c(CO32-)>c(HCO3-)
D.0.2 mol·L-1NaHCO3溶液与0.1 mol·L-1NaOH溶液等体积混合:c(CO32-)+2c(OH-)=c(HCO3-)+3c(H2CO3)+2c(H+)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南京市、盐城市高三第二次模拟考试化学试卷(解析版) 题型:选择题
下列指定反应的离子方程式正确的是
A.Cu与浓硝酸反应制备NO2:3Cu+8H++2NO3-===3Cu2++2NO2↑+4H2O
B.NH4Al(SO4)2溶液与过量NaOH溶液反应:Al3++4OH-===AlO2-+2H2O
C.用银氨溶液检验乙醛中的醛基:CH3CHO+2Ag(NH3)2++2OH-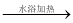 CH3COO-+NH4++3NH3+2Ag↓+H2O
CH3COO-+NH4++3NH3+2Ag↓+H2O
D.用H2O2从酸化的海带灰浸出液中提取碘:2I-+H2O2===I2+2OH-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市河北区高三总复习质量检测一化学试卷(解析版) 题型:填空题
(14分)已知C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态,且G为黄绿色;形成D的元素原子的最外层电子数是次外层的3倍;B的焰色反应呈紫色(透过蓝色钴玻璃);K为红棕色粉末。其转化关系如图。
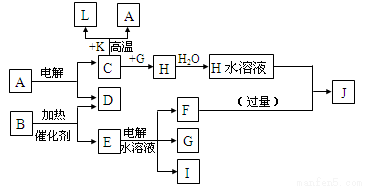
请回答:
(1)工业上制C用A不用H的原因 。
(2)写出C与K反应的化学方程式 ,该反应的反应物总能量 (填“大于”或“小于”)生成物总能量。
(3)L是目前应用最广泛的金属,用碳棒作阳极,L作阴极,接通电源(短时间)电解E水溶液的化学方程式 。
(4)写出E物质的电子式 。
(5)J与H反应的离子方程式为 。
(6)写出G与熟石灰反应制取漂白粉的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省达州市高三3月月考化学试卷(解析版) 题型:实验题
(本题14分)(Ⅰ)二氧化铈(CeO2)是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2以及其他少量可溶于稀酸的物质)。某课题组以此粉末为原料回收铈,设计实验流程如下:
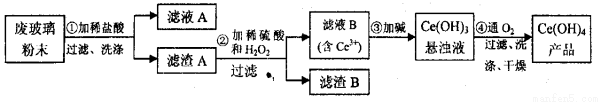
(1)洗涤的目的主要是为了除去Cl-和___________(填离子符号),检验该滤渣A洗净的方法是_____________________。
(2)第②步反应的离子方程式是____________________________。
(3)取上述流程中得到的Ce(OH)4产品0.536 g,加硫酸溶解后,用0.1000mol·L-1FeSO4标准溶液滴定终点时(铈被还原为Ce3+),消耗25.00mL标准溶液,该产品中Ce(OH)4的质量分数为_____________。
(Ⅱ)氧化镁在医药、建筑等行业应用广泛.硫酸镁还原热解制备高纯氧化镁是一种新的探索.以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:
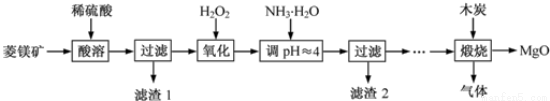
(1)加入H2O2氧化时,发生反应的化学方程式为________________。
(2)滤渣2的成分是______________(填化学式)。
(3)煅烧过程存在以下反应:2MgSO4+C=2MgO+2SO2↑+CO2↑
MgSO4+C=MgO+SO2↑+CO↑ MgSO4+3C=MgO+S↑+3CO↑
利用如图装置对煅烧产生的气体进行分步吸收或收集。

①D中收集的气体可以是______________(填化学式)。
②B中盛放的溶液可以是______________(填字母)。
A.NaOH溶液 B.Ca(OH)2溶液 C.稀硝酸 D.KMnO4溶液
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式:__________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省常德市高三模拟考试理综化学试卷(解析版) 题型:推断题
下列转化关系图中,A、B、C、D、E在常温下为气体,B、E、F为单质,其中F为黑色固体;C、D均能使澄清的石灰水变浑浊,D、E均能使品红溶液褪色;I是一种红棕色固体氧化物;反应④中固态F与G的浓溶液在加热时方能发生反应。
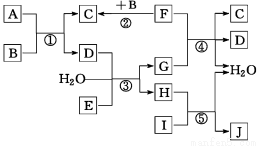
回答下列问题:
(1)I是一种红棕色粉末,俗称 ,常用于制造红色油漆和涂料;C分子中的化学键类型为 。
(2)测得室温下J溶液的pH=2.0,则由水电离产生的c(H+) = mol·L-1。
(3)反应③的离子方程式为 。
(4)反应④的化学方程式为 。
(5)A的密度为2.68 g·L-1(标准状况),通过计算推理,可确定A的分子式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015四川省邛崃市高二下学期第一次月考化学试卷(解析版) 题型:选择题
下列各组离子中,在碱性溶液中能大量共存,且溶液为无色透明的是
A.K+ MnO4- Cl- SO42- B.Na+ AlO2- Cl- SO42-
C.SO42- Na+ HCO3- Ba2+ D.Na+ NO3- NH4+ SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com