
| A、萃取时,要充分振荡混合液体并适当旋转活塞排气减压 |
| B、碘在CCl4中的溶解度比在水中的溶解度大,碘的CCl4溶液呈紫红色 |
| C、使用前要检查分液漏斗是否漏液 |
| D、分液时,水从分液漏斗下口流出,碘的CCl4溶液从漏斗上口倒出 |


 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:
| 温度 T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
| c(NH3?H2O) |
| c(OH-) |
| c(NH4+)?c(OH-) |
| c(NH3?H2O) |
| c(OH-) |
| c(H+) |

| 时间/浓度 | c(NH3) (mol/L) | c(O2 ) (mol/L) | c(NO) (mol/L) |
| 起始 | 0.8000 | 1.600 | 0.000 |
| 第2min | 0.6000 | a | 0.2000 |
| 第4min | 0.3000 | 0.9750 | 0.5000 |
| 第6min | 0.3000 | 0.9750 | 0.5000 |
| 第8min | 0.7000 | 1.475 | 0.1000 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 |
B、 |
C、 |
D、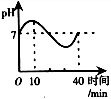 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、几千万年前地球上某条恐龙体内的某种原子可能在你的身体里 |
| B、用斧头将木块一劈为二,在这个过程中个别分子恰好分成原子 |
| C、一定条件下,石墨可以变成金刚石 |
| D、一定条件下,水能在2℃时结冰 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下的22.4L辛烷完全燃烧,生成的二氧化碳的分子数为8NA |
| B、1mol羟基中含有的电子数为9NA |
| C、标准状况下,14g氮气含有的核外电子数为5NA |
| D、标准状况下,铝跟氢氧化钠溶液反应生成1mol氢气时,转移的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向BaCl2与氯水的混合溶液中通入CO2气体 |
| B、向BaCl2与氨水的混合溶液中通入SO2气体 |
| C、向Ba(NO3)2与盐酸的混合溶液中通入SO2气体 |
| D、向NaHCO3与BaCl2的混合溶液中通入NH3气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 -→,O2
-→,O2  -→,SiO2
-→,SiO2  ,FeSiO3-→O2
,FeSiO3-→O2 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com