
如表为元素周期表中的一部分.用化学式或元素符号回答下列问题:
IA ⅡA ⅢA IVA VA ⅥA VⅡA 0
2 ⑥ ⑦
3 ① ③ ⑤ ⑧ ⑩
4 ② ④ ⑨
(1)10种元素中,化学性质最不活泼的是氩(填元素名称).
(2)在①②⑤的最高价氧化物的水化物中,碱性最强的是 (填化学式).
(3)①和⑤最高价氧化物对应的水化物相互反应的化学方程式为
(4)⑧与⑨分别与H2形成的氢化物的稳定性:HCl HBr,(用化学式表示)最高价氧化物对应的水溶液的酸性 .(用化学式)
考点: 元素周期律和元素周期表的综合应用.
分析: 由元素在周期表中的位置可知,①为Na,②为K,③为Mg,④为Ca,⑤为Al,⑥为C,⑦为O,⑧为Cl,⑨为Br,⑩为Ar,
(1)稀有气体化学性质稳定;
(2)同主族元素的原子,从下到上最高价氧化物对应水化物的酸性逐渐增强,碱性逐渐减弱,同一周期,元素单的金属性越强,其碱性越强;
(3)NaOH和氢氧化铝相互反应生成偏铝酸钠和水;
(4)元素的非金属性越强,其气态氢化物越稳定;非金属性越强,其最高价氧化物的水合物酸性越强.
解答: 解:依据分析可知:①为Na,②为K,③为Mg,④为Ca,⑤为Al,⑥为C,⑦为O,⑧为Cl,⑨为Br,⑩为Ar,
(1)上述元素中,最不活泼的为稀有气体Ar,名称为氩,故答案为:氩;
(2)由于金属性:K>Na>Al,故碱性最强的化合物为KOH,故答案为:KOH;
(3)NaOH和氢氧化铝相互反应生成偏铝酸钠和水,化学反应方程式为:Al(OH)3+NaOH═NaAlO2+2H2O,故答案为:Al(OH)3+NaOH═NaAlO2+2H2O;
(4)由于非金属性Cl>Br,故HCl的稳定性强于HBr,Cl的非金属性最强,故最高价氧化物对应的水溶液的酸性最强的是高氯酸,化学式为:HClO4,故答案为:HCl>HBr;HClO4.
点评: 本题是一道元素周期表结构和元素周期律知识的综合题目,要求学生具有分析和 解决问题的能力,难度不大.
解决问题的能力,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列实验操作中数据合理的是()
A. 用10mL量筒量取5.2mL盐酸
B. 用pH试纸测得某溶液的pH值为12.5
C. 用托盘天平称取25.12gNaCl固体
D. 用100mL容量瓶配制50mL0.1mol/L的盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
某强酸性溶液X中可能含有Fe2+、A13+、NH4+、CO32﹣、SO32﹣、SO42﹣、C1﹣中的若干种,现取X溶液进行连续实验,实验过程及产物如图.下列说法正确的是()
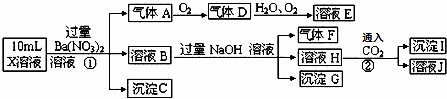
A. 气体A是NO2
B. X中肯定存在Fe2+、A13+、NH4+、SO42﹣
C. 溶液E和气体F不能发生化学反应
D. X中不能确定的离子是 A13+和C1﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
沼气是一种能源,它的主要成分是CH4,0.5molCH4完全燃烧生成CO2和液态水时放出445kJ的热最,则下列热化学方程式中正确的是()
A. 2CH4(g)+4O2(g)=2CO2(g)+4H2O(g)△H=+890kJ•mol﹣1
B. CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=+890kJ•mol﹣1
C. CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=﹣890kJ•mol﹣1
D. 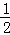 CH4(g)+O2(g)=CO2(g)+H2O(l)△H=﹣890kJ•mol﹣1
CH4(g)+O2(g)=CO2(g)+H2O(l)△H=﹣890kJ•mol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
我国第五套人民币中的一元硬币材料为钢芯镀镍,依据你所掌握的电镀原理,你认为在硬币制作时,钢芯应做()
A. 阴极 B. 阳极 C. 正极 D. 负极
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醛在酸性催化剂存在下三分子聚合可以生成性质相对稳定、毒性小、易于运输的三聚甲醛,反应如图所示.下列说法正确的是()

A. 甲醛水溶液可作为食物防腐剂
B. 该反应类型为缩聚反应
C. 三聚甲醛分子中既含σ键又含п键
D. 常温下,9g三聚甲醛中含1.806×1023个碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
已知前四周期五种元素X、Y、Z、W、T,它们的原子序数依次增大.X是空气中含量最多的元素;Y、W位于同周期,W单质在常温下是黄绿色气体,Y单质在其中燃烧发出黄色火焰;Z的氧化物常用作制备通讯光纤;T是常见金属,在氧气中燃烧可以得到具有磁性的黑色物质.回答下列问题:
(1)Z位于元素周期表中第三周期第ⅣA族;W基态原子核外电子排布式为 .
(2)Y和W的简单离子比较,半径较大的是 (填离子符号);键的极性比较:X﹣H Z﹣H(填“大于”或“小于”);Z单质和其氧化物比较,熔点较高的是 (填化学式).
(3)向T单质与稀硫酸反应后的溶液中滴加足量的NaOH溶液,能观察到的现象是 ;X与Y形成的原子个数比为1:3的简单化合物可与水反应生成两种碱,写出该物质与醋酸溶液反应的化学方程式 .
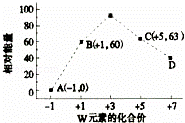
(4)一定条件下,在水溶液中1molW﹣、WO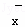 (z=1,2,3,4等)的能量(kJ)相对大小如图所示.
(z=1,2,3,4等)的能量(kJ)相对大小如图所示.
①D点对应的微粒是ClO4﹣(填离子符号).
②写出B→A+C反应的热化学方程式: (用离子符号表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙两个容器内都进行A→B的反应,甲容器内每分钟减少了4mol A,乙容器内每分钟减少2mol A,则甲容器内的反应速率比乙容器内的反应速率()
A. 快 B. 慢 C. 相等 D. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
我国成功发射“天宫一号”飞行器的长征Ⅱ火箭推进器中盛有强还原剂肼(N2H4)和强氧化剂液态双氧水(H2O2).当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热.已知此状况下:0.4mol液态肼与足量的液态双氧水反应放出256.0kJ的热量.(已知H2O(l)═H2O(g)△H=+44kJ•mol﹣1)
(1)则16g液态肼与液态双氧水反应在此状况下生成液态水时放出的热量是 kJ.
(2)(2)已知拆开1mol H﹣H键,1mol N﹣H键,1mol N≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com