
【题目】下列有关电解质溶液的说法正确的是
A. 向0.1mol![]() CH3COOH溶液中加入少量水,溶液中
CH3COOH溶液中加入少量水,溶液中![]() 减小
减小
B. 将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
C. 向盐酸中加入氨水至中性,溶液中![]()
D. 向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中![]() 不变
不变
科目:高中化学 来源: 题型:
【题目】可逆反应2SO2+O2![]() 2SO3,若用2 mol SO2和1 mol 18O2在一定条件下,经足够长的时间反应,下列情况可能出现的是
2SO3,若用2 mol SO2和1 mol 18O2在一定条件下,经足够长的时间反应,下列情况可能出现的是
A. 生成2 mol 三氧化硫 B. 18O完全存在于三氧化硫中
C. 18O仅存在于氧气、三氧化硫中 D. 18O存在于氧气、二氧化硫、三氧化硫中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的用途的说法不正确的是( )
A. SO2可用于漂白纸浆 B. 氢氧化铝、碳酸氢钠可用于治疗胃酸过多
C. 钢罐可用于储运浓硫酸 D. 磁性氧化铁可用于制备红色颜料和油漆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O 4e– = O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在CO2中,Mg燃烧生成MgO和C。下列说法正确的是
A. 元素C的单质只存在金刚石和石墨两种同素异形体
B. Mg、MgO中镁元素微粒的半径:r(Mg2+)>r(Mg)
C. 在该反应条件下,Mg的还原性强于C的还原性
D. 该反应属于非氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。

下列分析不正确的是
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH–
C.c点,两溶液中含有相同量的OH–
D.a、d两点对应的溶液均显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有8种元素的性质、数据如下表所列,它们属于第二或第三周期。
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
-2 | -3 | -1 | -3 |
回答下列问题:
(1)③的元素符号是____________,⑧的元素名称是____________。①在元素周期表中的位置是(周期、族)______________。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是_______________;名称是____________;碱性最强的化合物的电子式是:_______________________________; 属何类化合物(指离子化合物或共价化合物)_______________________。
(3)比较④和⑦的氢化物的稳定性____________________
(4)写出⑦的最高价氧化物对应水化物跟它的氢化物反应的化学方程式__________________。
(5)写出②最高价氧化物对应水化物跟⑤的氢化物水溶液反应的离子方程式 ______________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2C2O4为二元弱酸。20℃配制一组c(H2C2O4)+c(HC2O4–)+c(C2O42–)=0.100 mol·L–1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。一定正确的是
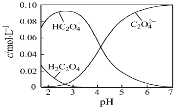
A.pH=2.5的溶液中:c(H2C2O4)+c(C2O42–)>c(HC2O4–)
B.c(Na+)=0.100 mol·L–1的溶液中:c(H+)+c(H2C2O4)=c(OH–)+c(C2O42–)
C.c(HC2O4–)=c(C2O42–)的溶液中:c(Na+)>0.100 mol·L–1+c(HC2O4–)
D.pH=7的溶液中:c(Na+)<2c(C2O42–)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】摩尔盐易[(NH4)2Fe(SO4)2]易溶于水,具有还原性。以下是利用废铁屑、稀硫酸和硫酸铵为原料制取摩尔盐的流程图。

回答下列问题:
(1)在“步骤l”中加Na2CO3溶液是为了洗涤除去废铁屑表面的油污,加热的目的是______(利用简要文字和必要的离子方程式说明),配制100g10%的Na2CO3溶液需要的仪器有药匙、量筒、烧杯、玻璃棒和_______;
(2)“步骤2”中所用废铁屑必须过量,原因是______________;
(3)“步骤3”加入(NH4)2SO4固体充分搅拌溶解后,依次进行的实验操作是:蒸发浓缩、______、过滤、洗涤、干燥;
(4)一般采用滴定法测定摩尔盐产品中Fe2+的含量:称取4.0g摩尔盐样品,溶于水,加入适量稀硫酸,用0.2 mol/LKMnO4溶液滴定,达到终点时,消耗10.00 mL KMnO4溶液。
① 滴定过程中发生反应的离子方程式为___________;
② 产品中Fe2+的质量分数为_________;
③ 滴定过程中.左手控制________,右手摇动锥形瓶,直到_________时停止滴定,读数。此时若俯视读数.测定结果将偏________(填“高”或“低”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com