
【题目】下列溶液:①pH=0的盐酸,②0.5mol·L-1的盐酸溶液,③0.1mol·L-1的氯化铵溶液,④0.1mol·L-1的氢氧化钠溶液,⑤0.1mol·L-1的氟化钠溶液,由水电离的H+浓度由大到小的顺序正确的是
A. ①②③④⑤B. ③⑤④②①C. ①②③⑤④D. ⑤③④①②
【答案】B
【解析】
水的电离平衡:H2O ![]() H++OH-,在水中加入酸或碱,抑制水的电离,可水解的盐促进水的电离,酸溶液中OH-是水电离的,碱溶液中H+是水电离,结合Kw=c(H+)×c(OH-)进行计算;
H++OH-,在水中加入酸或碱,抑制水的电离,可水解的盐促进水的电离,酸溶液中OH-是水电离的,碱溶液中H+是水电离,结合Kw=c(H+)×c(OH-)进行计算;
水的电离平衡:H2O ![]() H++OH-,水电离出的H+等于水电离OH-,
H++OH-,水电离出的H+等于水电离OH-,
①pH=0的盐酸中c(OH-)=![]() =10-14mol·L-1,即水电离出的c(H+)=10-14mol·L-1;
=10-14mol·L-1,即水电离出的c(H+)=10-14mol·L-1;
②0.5mol·L-1的盐酸溶液中c(H+)=0.5mol·L-1,溶液中c(OH-)=![]() =2×10-14mol·L-1,即水电离出的c(H+)=2×10-14mol·L-1;
=2×10-14mol·L-1,即水电离出的c(H+)=2×10-14mol·L-1;
③NH4Cl为强酸弱碱盐,NH4+水解,使NH4Cl溶液显酸性,促进水的电离;
④0.1mol·L-1NaOH溶液中c(OH-)=0.1mol·L-1,水电离c(H+)=10-13mol·L-1;
⑤NaF为强碱弱酸盐,F-水解,使NaF溶液显碱性,促进水的电离;
③和⑤促进水的电离,由于NH3·H2O的电离程度小于HF,等物质的量浓度的NH4+水解程度大于F-,即氯化铵溶液中水电离出的c(H+)大于NaF溶液中水电离出的c(H+),综上所述水电离出c(H+)由大到小的顺序是③⑤④②①,故选项B正确;
答案选B。


科目:高中化学 来源: 题型:
【题目】KIO3是我国规定的食盐补碘剂,利用“KClO3氧化法”可制备KIO3,流程如下:
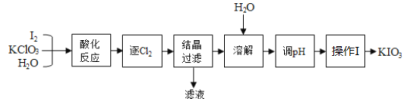
已知:“酸化反应”所得产物有KH(IO3)2、Cl2和KCl。
(1)KIO3所含的化学键有______________________。
(2)逐出的Cl2可用_________________检验;“滤液”中的溶质主要是____________;“调pH”中所用的试剂是_________________。
(3)已知KIO3在水中的溶解度随温度升高而增大,则操作I包含的操作应该是_______、_______、过滤。
(4)为测定“加碘食盐”中碘元素含量:①称取50.000g食盐,配成250mL溶液;②量取25.00mL溶液于锥形瓶中,加入足量KI,并用少量稀硫酸酸化,使KIO3与KI反应完全;③以淀粉为指示剂,用2.0×10-4mol/L的Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液体积为30.00mL。已知:KIO3+KI+H2SO4→K2SO4+I2+H2O(未配平),2Na2S2O3+I2→Na2S4O6+2NaI。测定过程中,所需仪器在使用前必须检查是否漏液的有________________。
(5)判断滴定终点的依据是________________________________。
(6)配平:KIO3+KI+H2SO4→K2SO4+I2+H2O ____________
(7)该食盐中碘元素的含量是_________mg/kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请应用化学反应原理的相关知识解决下列问题
(1)已知NaCl的溶解热为3.8kJ·mol-1(吸热)
Na(s)-e-====Na+(aq) △H=-240 kJ/mol
![]() Cl2(g)+e-====Cl-(aq) △H=-167 kJ/mol
Cl2(g)+e-====Cl-(aq) △H=-167 kJ/mol
写出钠在氯气中燃烧的热化学方程式_______________________。
(2)一定条件下,在2L恒容密闭容器中充入1.5 mol CO2和3molH2发生反应:CO2(g)+3H2(g) ![]() CH3OH(g) +H3O(g)
CH3OH(g) +H3O(g)
下图是反应体系中CO2的平衡转化率与温度的关系曲线。已知在温度为500K的条件下,该反应l0min达到平衡;
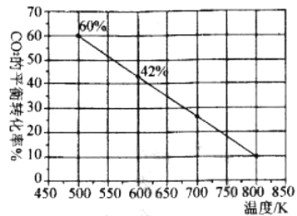
①该反应是__________ (填“吸热”或“放热”)反应。
②在0~10min时段反应速率v(H2)为__________。
③若改充入2 mol CO2和3molH2,图中的曲线会__________(填“上移”或“下移”)。
(3)根据下表数据回答问题:
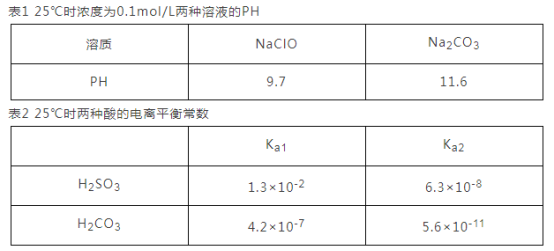
①根据表1能不能判断出H2CO3与HClO酸性强弱? _________(填“能”或“不能”)。
②0.10mol·L-lNa2SO3溶液中离子浓度由大到小的顺序为___________________________。
③H2SO3溶液和 NaHCO3溶液反应的离子方程式为________________________________。
(4)已知:t℃时,Ksp(AgCl)=1.5×10-10、Ksp (Ag2CrO4)=2.0×10-12;AgCl为白色沉淀,Ag2CrO4为砖红色沉淀,t℃时,向Cl-和CrO42-浓度均为0.1mol/L的混合溶液中逐滴加入AgNO3溶液至过量且不断搅拌,实验现象为_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在相同的A、B密闭容器中分别充入2 mol SO2和1 mol O2,使它们在一定温度下反应,并达新平衡:2SO2+O2![]() 2SO3(g)。若A容器保持体积不变,B容器保持压强不变。当A中SO2的转化率为25%时,B中SO2的转化率为
2SO3(g)。若A容器保持体积不变,B容器保持压强不变。当A中SO2的转化率为25%时,B中SO2的转化率为
A. 25%B. 大于25%
C. 小于25%D. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、H、O三种元素在人体内质量分数约为73%左右,而在组成岩石圈的化学成分中还不到1%,这一事实说明了( )
A. 生物界与非生物界具有相似性
B. 生物界与非生物界的元素组成是不同的
C. 生物界与非生物界具有统一性
D. 生物界与非生物界存在差异性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可利用如下反应将二氧化碳转化为甲烷:CO2(g)+2H2O(g) ![]() CH4(g)+2O2(g) ΔH=+802KJ/mol,下图为在恒温、光照、不同初始浓度和不同催化剂(Ⅰ、Ⅱ)作用下,体积为2L的莫比容器中n(CH4)随光照时间的变化曲线。下列说法正确的是
CH4(g)+2O2(g) ΔH=+802KJ/mol,下图为在恒温、光照、不同初始浓度和不同催化剂(Ⅰ、Ⅱ)作用下,体积为2L的莫比容器中n(CH4)随光照时间的变化曲线。下列说法正确的是
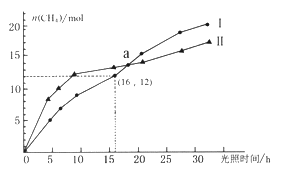
A. 0-15h内,催化剂Ⅱ的催化效果比催化剂Ⅰ效果好
B. 反应开始后的30h内,第Ⅰ种催化剂的作用下,反应吸收的热量多
C. a点时,CO2的转化率相等
D. 0-16h内,v(O2)=1.5mol/(L·h)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是
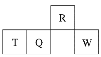
A. 最简单气态氢化物的热稳定性:R>Q
B. 最高价氧化物对应水化物的酸性:Q>W
C. 原子半径:T>Q>R
D. 单质T既可以与盐酸反应又能与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大。四种元素形成的单质依次为m、n、p、q;这些元素组成的二元化合物r、t、u,其中u能使品红溶液退色,v的俗名叫烧碱。上述物质的转化关系如图所示。下列说法正确的是( )
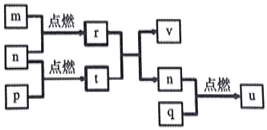
A. 原子半径的大小:W>Z>Y>X
B. t与r反应时,r为氧化剂
C. 生活中可用u使食物增白
D. Z分别与Y、W组成的化合物中化学健类型可能相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com