
分析 反应中二氧化铅中+4价铅,化合价降为硝酸铅、硫酸铅中+2价,硫酸锰中+2价锰化合价升高为高锰酸中+7价,依据氧化还原反应中得失电子守恒、原子个数守恒配平方程式;
依据元素化合价变化判断电子转移方向及数目,用双线桥表示.
解答 解:应中二氧化铅中+4价铅,化合价降为硝酸铅、硫酸铅中+2价,硫酸锰中+2价锰化合价升高为高锰酸中+7价,依据得失电子守恒,二者得失电子最小公倍数为10,则二氧化铅系数为5,硫酸锰系数为5,依据原子个数守恒,方程式:5PbO2+2MnSO4+6HNO3═2HMnO4+3Pb(NO3)2+2PbSO4↓+2H2O;
反应中二氧化铅中+4价铅得到电子,硫酸锰中+2价锰失去电子,消耗5mol二氧化铅转移10mol电子,用双线桥表示为: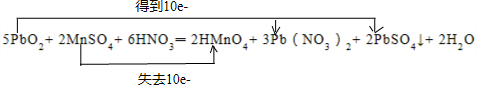 ;
;
故答案为: .
.
点评 本题考查了氧化还原反应方程式书写及表示方法,准确分析反应中元素化合价变化,依据氧化还原反应得失电子数守恒、原子个数守恒规律即可解答,题目难度中等.


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热的反应发生时不必加热,吸热反应都需要加热后才能发生 | |
| B. | 化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关 | |
| C. | 化学反应一定有能量变化,当△H为“-”时,表示该反应为吸热反应 | |
| D. | 已知C(s)+$\frac{1}{2}$O2(g)=CO(g)的反应热为-110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com