
| A. | NH4+、SO32-、AlO2- | B. | NH4+、Br-、CO32- | ||
| C. | Fe2+、S2-、SO32- | D. | NH4+、Br-、AlO2- |
分析 向该溶液中滴加足量氯水后,有气泡产生并生成橙色澄清溶液,则一定含CO32-、Br-,向所得橙色溶液中加入BaCl2溶液时无沉淀生成,则一定不含SO32-,结合离子的共存及电荷守恒来解答.
解答 解:向该溶液中滴加足量氯水后,有气泡产生并生成橙色澄清溶液,则一定含CO32-、Br-,一定不含S2-,由离子共存可知不含Fe2+,
向所得橙色溶液中加入BaCl2溶液时无沉淀生成,则一定不含SO32-,
由电荷守恒可知一定含阳离子为NH4+,且AlO2-、NH4+不能共存,
故选B.
点评 本题考查常见离子的检验,为高频考点,把握离子之间的反应与现象、电荷守恒为解答的关键,侧重分析与实验能力的考查,注意电荷守恒的应用,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
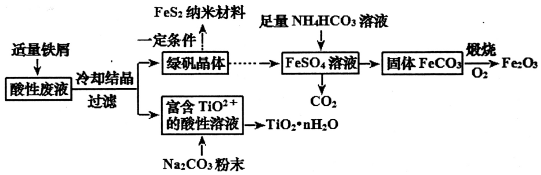
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
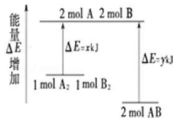
| A. | 该反应是吸热反应 | |
| B. | 断裂 1molA-A 键和 1mol B-B 键放出 xkJ 能量 | |
| C. | 断裂 2molA-B 键需要吸收 y kJ 的能量 | |
| D. | 1molA2和 1molB2 的总能量低于 2molAB 的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
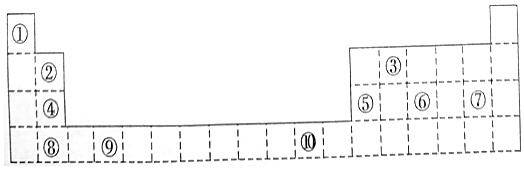
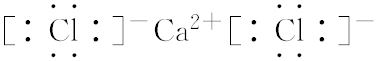 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
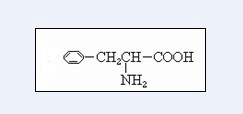 .
.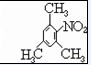 .
.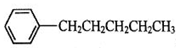 、
、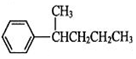 、
、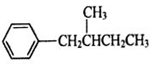
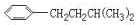 、
、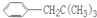 、
、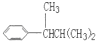 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
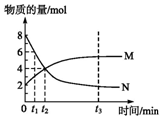 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列表述正确的是( )
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列表述正确的是( )| A. | 化学方程式:2N?M | B. | t2时,正逆反应速率相等,达到平衡 | ||
| C. | t3时,正反应速率大于逆反应速率 | D. | t1时,M的浓度是N浓度的2倍 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com