
【题目】锌锰电池(俗称干电池)在生活中的用量很大。两种锌锰电池的构造如图(a)所示。回答下列问题:

(1)普通锌锰电池放电时发生的主要反应为:Zn+2NH4Cl+2MnO2===Zn(NH3)2Cl2+2MnOOH,该电池中,负极材料主要是______________,电解质的主要成分是________,正极发生的主要反应是________________________
(2)与普通锌锰电池相比,碱性锌锰电池的优点及其理由是____________________________。
【答案】 Zn NH4Cl MnO2+NH4++e-=MnOOH+NH3 碱性电池不易发生电解质的泄露,因为消耗的负极改装在电池的内部,碱性电池的使用寿命较长,因为金属材料在碱性电解质中比在酸性电解质中的稳定性提高。
【解析】(1)根据化学方程式Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH,反应中Zn被氧化,为电池负极锌,氯化铵是电解质的主要成分,二氧化锰和铵根离子在正极发生反应,MnO2+NH4++e-=MnOOH+NH3,故答案为:锌;NH4Cl;MnO2+NH4++e-=MnOOH+NH3;
(2)与普通锌锰电池相比,碱性电池不易发生电解质的泄露,因为消耗的负极改装在电池的内部,碱性电池的使用寿命较长,因为金属材料在碱性电解质中比在酸性电解质中的稳定性提高,故答案为:碱性电池不易发生电解质的泄露,因为消耗的负极改装在电池的内部,碱性电池的使用寿命较长,因为金属材料在碱性电解质中比在酸性电解质中的稳定性提高。


科目:高中化学 来源: 题型:
【题目】下列实验方法能达到实验目的的是
A. 用淀粉溶液检验溶液中是否存在碘化钾
B. 用分液漏斗分离苯与酒精的混合物
C. 用氯化钡溶液鉴别碳酸钠溶液与硫酸钠溶液
D. 用丁达尔效应区分氢氧化铁胶体和FeCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普通水泥在固化过程中其自由水分子减少并形成碱性溶液。根据这一物理化学特点,科学家发明了电动势法测水泥的初凝时间。此法的原理如图所示,反应的总方程式为2Cu+Ag2O===Cu2O+2Ag,下列有关说法正确的是 ( )

A. 2 mol Cu与1 mol Ag2O的总能量低于1 mol Cu2O与2 mol Ag具有的总能量
B. 负极的电极反应式为2Cu+2OH--2e-===Cu2O+H2O
C. 测量原理示意图中,电流方向从Cu→Ag2O
D. 电池工作时,OH-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分中学化学常见元素的原子结构及性质如下表所示:
元素 | 结构及性质 |
A | A单质是生活中的常见金属,它有两种氯化物,相对分子质量相差35.5 |
B | B原子最外层电子数是内层电子总数的1/5 |
C | C是常见化肥的主要元素,单质常温下呈气态 |
D | D是地壳中含量最丰富的金属元素,工业上可通过电解法获取其单质 |
E | 通常情况下,E没有正化合价,A、B、C、D、F都能与E形成化合物 |
F | F在周期表中可以排在IA族,也有人提出排在VIIA族 |
(1)A元素在周期表中的位置为第_____周期_____族。
(2)B与C形成的化合物的化学式为______,它属于____(填“离子”或“共价”)化合物。
(3)F与E可以形成原子个数比分别为2:1、1:1的两种化合物X和Y。区别X与Y的水溶液的实验方法是_________________________________________。
(4)C与E都是较活泼的非金属元素,两者的非金属性强弱比较:_____>______(用化学符号回答),请例举出一个判断二者非金属性强弱的证据是____________________。
(5)有人认为B、D的单质用导线连接后插入NaOH溶液中可以形成原电池,你认为是否可以,若可以,试写出负极的电极方程式(若认为不行可不写)_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BaCO3与稀硝酸反应,正确的离子方程式是( )
A.Ba2++CO32﹣+2H+=Ba(NO3)2+H2O+CO2↑
B.BaCO3+2H+=Ba2++H2O+CO2↑
C.BaCO3+2H++2NO3﹣=Ba(NO3)2+H2O+CO2↑
D.CO32﹣+2H+=H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
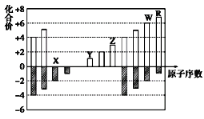
A. 原子半径:Z>Y>X
B. 气态氢化物的稳定性:R<W
C. WX3和水反应形成的化合物是离子化合物
D. Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为实现实验目的,选用的装置、实验操作均正确的是( )
实验目的 | 实验步骤和装置 | |
A | 探究温度对反应速率的影响 | 不同温度下,取0.1 mol/LKI 溶液,向其中先加入淀粉溶液,再加入0.1 mol/L 硫酸,记录溶液出现蓝色的时间 |
B | 配制100mL1.0mol/L NaOH溶液 | 向100mL容量瓶中加入4. 0gNaOH固体,加水到刻度线 |
C | 验证牺牲阳极的阴极保护法 |
往铁电极附近滴加铁氰化钾溶液 |
D | 比较H2O2 和Fe3+的氧化性 | 将盐酸酸化的双氧水滴入Fe(NO3)2溶液中 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列4种重要的有机物:
①![]() ②
②![]() ③
③![]() ④
④![]()
请回答:
(1)能发生银镜反应的是______(填序号)。
(2)能与浓硝酸在一定条件下生成烈性炸药TNT的是______(填序号)。
(3)能与③在一定条件下反应并相互缩合成高分子化合物的是______(填序号)。
(4)写出④在一定条件下发生消去反应的化学方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A. 常温常压下,11.2L二氧化硫所含的氧原子数等于NA
B. 0.5molH2O所含的电子数为9NA
C. 8.0gCu2S和CuO的混合物中含有铜原子数为0.1NA
D. 300mL2mol·L-1蔗糖溶液中所含分子数为0.6NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com