
 2015年我国药物化学家屠吆吆因发明抗疟疾新药青蒿素和双氢青蒿素被授予诺贝尔生理学或医学奖.以异胡薄荷醇为起始原料是人工合成青蒿素的途径之一(如图).下列说法正确的是( )
2015年我国药物化学家屠吆吆因发明抗疟疾新药青蒿素和双氢青蒿素被授予诺贝尔生理学或医学奖.以异胡薄荷醇为起始原料是人工合成青蒿素的途径之一(如图).下列说法正确的是( )| A. | 异胡薄荷醇遇FeCl3溶液显紫色 | |
| B. | 异胡薄荷醇可发生消去反应、加成反应 | |
| C. | 青蒿素分子中含有7个手性碳原子 | |
| D. | 青蒿素在热的酸、碱溶液中均可稳定存在 |
分析 A.异胡薄荷醇遇含有醇羟基和碳碳双键,具有醇和烯烃性质;
B.异胡薄荷醇遇含有醇羟基和碳碳双键,且连接醇羟基邻位上含有氢原子,所以能发生消去反应,碳碳双键能发生加成反应;
C.根据手性碳原子的定义判断;
D.青蒿素含有酯基,可发生水解反应.
解答 解:A.异胡薄荷醇遇含有醇羟基和碳碳双键,具有醇和烯烃性质,没有酚羟基,所以不能发生显色反应,故A错误;
B.异胡薄荷醇遇含有醇羟基和碳碳双键,且连接醇羟基邻位上含有氢原子,所以能发生消去反应,碳碳双键能发生加成反应,故B正确;
C.手性碳原子连接4个不同的原子或原子团,手性碳原子标识如图: ,共7个,故C正确;
,共7个,故C正确;
D.青蒿素含有酯基,可发生水解反应,可与酸、碱发生反应,故D错误.
故选BC.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,此类题目注意把握物质的结构和官能团的性质,易错点为C,注意手性碳原子的判断.


科目:高中化学 来源: 题型:解答题
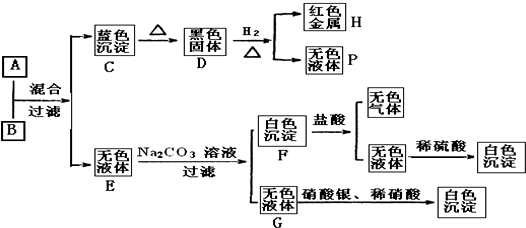
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据是否含氧元素,将物质分为氧化剂和还原剂 | |
| B. | 根据反应中是否有电子转移,将化学反应分为氧化还原反应和非氧化还原反应 | |
| C. | 根据水溶液是否能够导电,将物质分为电解质和非电解质 | |
| D. | 根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编码 | 实验 | 现象 |
| A | 加热放在坩埚中的小块钠 | 钠先融化成光亮的小球,燃烧时,火焰为黄色,燃烧后,生成淡黄色固体 |
| B | 在酒精灯上加热铝箔 | 铝箔融化,失去光泽,融化的铝并不滴落,好像一层膜兜着 |
| C | 在空气中久置的铝条放入NaOH溶液中 | 铝条立刻产生大量无色气泡,铝条逐渐变细,铝条逐渐发热 |
| D | 在FeCl2溶液中滴入NaOH溶液 | 生成白色沉淀,沉淀很快变为灰绿色,最后变为红褐色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
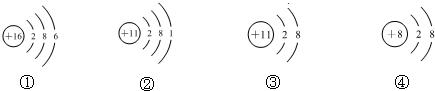
| A. | 它们表示四种元素 | |
| B. | ②③的化学性质相同 | |
| C. | ②表示的元素是金属元素 | |
| D. | ①表示的是原子,而④表示的是阴离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

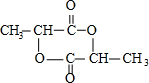 ;
; )在一定条件下可发生类似反应①的反应,生成芳香族聚碳酸酯,写出反应的化学方程式:2n
)在一定条件下可发生类似反应①的反应,生成芳香族聚碳酸酯,写出反应的化学方程式:2n +n
+n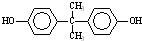 →
→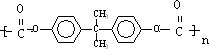 +4nCH3OH.
+4nCH3OH.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲烷是天然气的主要成分,是生产生活中应用非常广泛的一种化学物质.
甲烷是天然气的主要成分,是生产生活中应用非常广泛的一种化学物质.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com