
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
分析 (1)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,水不需要写出,据此书写;加入NaOH,中和氢离子,氢离子浓度降低,平衡向右移动;加入酸,H+浓度增大,平衡左移,Cr2O72-浓度增大;
(2)①由表中数据可知,温度越高平衡常数越小,故升高温度平衡向逆反应移动,正反应为放热反应;计算出浓度商,根据平衡常数判断平衡移动方向;
②设平衡时CO的物质的量浓度变化为c,利用三段式表示出平衡时CO、CO2的物质的量浓度,化学计量数都是1,利用物质的量代替浓度代入平衡常数计算c,利用v=$\frac{△c}{△t}$计算v(CO),再利用转化率定义计算CO的转化率;
③提高CO的平衡转化率,应使平衡向正反应移动,但不能增大CO的用量,结合选项根据平衡移动原理分析.
解答 解:(1)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,水不需要写出,即该反应的平衡常数为:K=$\frac{{c}^{2}({H}^{+})•{c}^{2}(Cr{{O}_{4}}^{2-})}{c(C{r}_{2}{{O}_{7}}^{2-})}$;
加入NaOH,中和氢离子,氢离子浓度降低,平衡向右移动,显黄色;加入酸,H+浓度增大,平衡左移,Cr2O72-浓度增大,显橙红色,
故答案为:$\frac{{c}^{2}({H}^{+})•{c}^{2}(Cr{{O}_{4}}^{2-})}{c(C{r}_{2}{{O}_{7}}^{2-})}$;显橙红色,显黄色;
(2)①由表中数据可知,温度越高平衡常数越小,故升高温度平衡向逆反应移动,正反应为放热反应,即△H<0;
1150℃时,平衡常数K=3.7,当CO、CO2浓度均为1.0mol/L时,其浓度商Qc=$\frac{c(C{O}_{2})}{c(CO)}$=1<3.7,说明生成物浓度较小,平衡正向着正向移动,
故答案为:<;正向;
②设平衡时CO的物质的量浓度变化为cmol/L,则
则:$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)
开始(mol/L):0.1 0.1
变化(mol/L):c c
平衡(mol/L):0.1-c 0.1+c
所以$\frac{0.1+c}{0.1-c}$=4,解得:c=0.06,
所以v(CO2)=$\frac{0.06mol/L}{10min}$=0.006 mol•L-1•min-1;
CO的平衡转化率为:$\frac{0.06mol/L}{0.1mol/L}$×100%=60%,
故答案为:0.006 mol•L-1•min-1;60%;
③A.铁是固体,减少Fe的量,不影响平衡移动,CO的平衡转化率不变,故A错误;
B.氧化铁是固体,增加Fe2O3的量,不影响平衡移动,CO的平衡转化率不变,故B错误;
C.移出部分CO2,平衡向正反应移动,CO的平衡转化率增大,故C正确;
D.该反应正反应是放热反应,提高反应温度,平衡向逆反应移动,CO的平衡转化率降低,故D错误;
E.反应前后气体的物质的量不变,减小容器的容积,增大压强平衡不移动,CO的平衡转化率不变,故E错误;
F.加入合适的催化剂,平衡不移动,故F错误;
故答案为:C.
点评 本题考查较为综合,涉及化学平衡常数、反应速率、转化率、化学平衡及其影响等知识,题目难度中等,明确化学平衡及其影响为解答关键,注意掌握化学平衡常数、化学反应速率的概念及表达式,试题培养了学生的化学计算能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 甲 | 乙 | 丙 | 丁 | ||
| 密闭容器体积/L | 2 | 2 | 2 | 1 | |
| 起始物质的量 | n(SO2)/mol | 0.4 | 0.8 | 0.8 | 0.4 |
| n(O2)/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
| SO2的平衡转化率/% | 80 | α1 | α2 | α3 | |
| A. | SO2的平衡转化率:α1>α2=α3 | B. | SO3的物质的量浓度:c(甲)=c(丁)<c(丙) | ||
| C. | 甲、乙中的平衡常数:K(甲)=K(乙)=400 | D. | 丙、丁中的平衡常数:K(丙)<K(丁) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知卤化银AgX的沉淀溶解平衡曲线如图所示,横坐标p(Ag+)=-lg(Ag+),纵坐标Y=-lg(X-),下列说法正确的是( )
已知卤化银AgX的沉淀溶解平衡曲线如图所示,横坐标p(Ag+)=-lg(Ag+),纵坐标Y=-lg(X-),下列说法正确的是( )| A. | 该温度下AgCl的Ksp约为1×10-15 | |
| B. | a点可表示AgCl的过饱和溶液 | |
| C. | b点时c(Ag+)=c(I-) | |
| D. | 该温度下,AgCl和AgBr饱和溶液中:c(Cl-)<c(Br-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
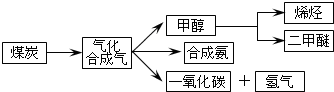
| 物质 | CH3OH | CH3OCH3 | H2O |
| c/(mol•L-1) | 0.8 | 1.24 | 1.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| X(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| X(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com