
氯碱工业是最基本的化学工业之一,离子膜电解法为目前普遍使用的生产方法,其生产流程如图所示:
(1)该流程中可以循环的物质是 。
(2)电解法制碱的主要原料是饱和食盐水,由 于粗盐水中含有Ca2+、Mg2+、SO42-等无机杂质,所以在进入电解槽前需要进行两次精制,写出一次精制中发生的离子方程式 ,若食盐水不经过二次精制就直接进入离子膜电解槽会产生什么后果 。
(3)如图是工业上电解饱和食盐水的离子交换膜电解槽示意图(阳极用金属钛网制成,阴极由碳钢网制成)。则B处产生的气体是 , E电极的名称是 。电解总反应的离子方程式为 。
(4)从阳极槽出来的淡盐水中,往往含有少量的溶解氯,需要加入8%~9%的亚硫酸钠溶液将其彻底除去,该反应的化学方程式为 。
(5)已知在电解槽中,每小时通过1安培的直流电可以产生1.492g的烧碱,某工厂用300个电解槽串联生产8小时,制得32%的烧碱溶液(密度为1.342吨/m3)113m3,电解槽的电流强度1.45 ×104A,该电解槽的电解效率为 。
(1)氯化钠 氢氧化钠
(2)Ca2++ CO32-= CaCO3↓ ;Mg2+ + 2OH-= Mg(OH)2↓ 用试剂处理后的盐水中还含有少量Mg2+、Ca2+,碱性条件下会生成沉淀,损害离子交换膜。
(3)H2 阳极 2Cl-+2H2O Cl2↑+H2↑+2OH-(4)Na2SO3 + Cl2 + H2O = Na2SO4 + 2HCl
Cl2↑+H2↑+2OH-(4)Na2SO3 + Cl2 + H2O = Na2SO4 + 2HCl
(5)ηOH-=(W实 /W理)×100%=(113×32%×1.342×106)/(1.492×1.45×104×300×8)= 48.53/51.92 = 93.46%
解析试题分析:(1)由流程图可以看出:在该流程中可以循环的物质是氯化钠、氢氧化钠。(2)在一次精制中加入Na2CO3溶液发生反应:Ca2++ CO32-= CaCO3↓;加入NaOH发生反应:Mg2+ + 2OH-= Mg(OH)2↓。若食盐水不经过二次精制,用试剂处理后的盐水中还含有少量Mg2+、Ca2+,碱性条件下会生成沉淀,损害离子交换膜。(3)根据同种电荷相互排斥,异种电荷相互吸引的原则,Na+不断向F电极区移动,则E电极为阳极,发生的电极反应为:2Cl--2e-=Cl2↑ 。F电极为阴极。在阴极发生的反应为:2H++2e-=H2↑ 。则B处产生的气体是H2. 电解总反应的离子方程式为2Cl-+2H2O Cl2↑+H2↑+2OH- 。(4)氯气与Na2SO3发生氧化还原反应的化学方程式为:Na2SO3 + Cl2 + H2O = Na2SO4 + 2HCl。(5)m(NaOH实际)= 1.342吨/m3×113m3×32%=48.527t=4.8527×107g, m(NaOH理论)= 1.492×1.45×104×300×8g=5.19216×107g. 该电解槽的电解效率为m(NaOH实际)÷m(NaOH理论) ×100%=4.8527×107g÷5.19216×107g×100%=93.46%.
Cl2↑+H2↑+2OH- 。(4)氯气与Na2SO3发生氧化还原反应的化学方程式为:Na2SO3 + Cl2 + H2O = Na2SO4 + 2HCl。(5)m(NaOH实际)= 1.342吨/m3×113m3×32%=48.527t=4.8527×107g, m(NaOH理论)= 1.492×1.45×104×300×8g=5.19216×107g. 该电解槽的电解效率为m(NaOH实际)÷m(NaOH理论) ×100%=4.8527×107g÷5.19216×107g×100%=93.46%.
考点:考查在氯碱工业生产中的反应原理的化学方程式、离子方程式的书写、操作的原因及电解效率的计算的知识。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
某原电池装置中盛有浓KOH溶液,若分别向__________(填“正”或“负”,下同)极通入可燃性气体,向__________极通入O2,则电路中就有电流通过,电流方向由__________极流向__________极,溶液中OH-向__________极移动。试完成下列问题:
| | 可燃性气体 | 正极反应 | 负极反应 | 电池总反应 | pH变化 |
| (1) | H2 | | | | |
| (2) | CO | | | | |
| (3) | CH4 | | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
电极a、b分别为Ag电极和Pt电极,电极c、 d都 是 石墨电极。通电一段时间后,在c、d两极上共收集到336mL(标准状态)气体。回答:
(1)直流电源中,M为______________极。
(2)Pt电极上生成的物质是____________,其质量为____________g 。
(3)电子转移的物质的量与电极b、c、d分别生成的物质的物质的量之比为________。
(4)电解过程中,AgNO3溶液的浓度______________(填“增大”、“减小”或“不变”,
下同),AgNO3溶液的pH__________,H2SO4溶液的浓度_________ ,H2SO4溶液的pH________ 。
(5)若H2SO4溶液的质量分数由5.00%变为5.02%,则原有5.00%的H2SO4溶液为______g。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
化学在能源开发与利用中起着十分关键的作用。氢气是一种新型的绿色能源,又是一种重要的化工原料。
Ⅰ.氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行如图所示的实验(图中所用电极均为惰性电极):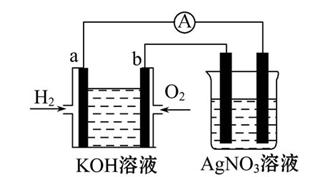
(1)对于氢氧燃料电池,下列表达不正确的是 。
| A.a电极是负极,OH-移向负极 |
| B.b电极的电极反应为:O2+2H2O+4e-=4OH- |
C.电池总反应式为:2H2+O2 2H2O 2H2O |
| D.电解质溶液的pH保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
Ⅰ:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=206.0 kJ·mol-1
Ⅱ:CO(g)+2H2(g)=CH3OH(g) ΔH=-129.0 kJ·mol-1
(1)CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为______________________________________________________。
(2)将1.0 mol CH4和2.0 mol H2O(g)通入容积为100 L的反应室,在一定条件下发生反应Ⅰ,测得在一定的压强下CH4的转化率与温度的关系如右图。
①假设100 ℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为________。
②100 ℃时反应Ⅰ的平衡常数为________。
(3)在压强为0.1 MPa、温度为300 ℃条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下发生反应Ⅱ生成甲醇,平衡后将容器的容积压缩到原来的 ,其他条件不变,对平衡体系产生的影响是________(填字母序号)。
,其他条件不变,对平衡体系产生的影响是________(填字母序号)。
| A.c(H2)减少 |
| B.正反应速率加快,逆反应速率减慢 |
| C.CH3OH 的物质的量增加 |
| D.重新平衡c(H2)/c(CH3OH)减小 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2 ,电解
质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液的电解实验,如图所示。
回答下列问题:
(1)甲烷燃料电池正极的电极反应式为 、负极的电极反应式为 。
(2)闭合K开关后,a、b电极上均有气体产生.其中b电极上得到的是 ,电解氯化钠溶液的化学方程式为 ;若电解一段时间后,石墨棒上产生标准状况下的Cl2 224 mL,电解后的溶液总体积为200 mL,则溶液的pH = 。
(3)若每个电池甲烷通入量为 1 L(标准状况),且反应完全,则理论上通过电解池的电量为 (法拉第常数F = 9.65×l04C· mol-1,列式计算),最多能产生的氯气体积为 L (标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
人工肾脏可采用间接电化学方法除去代谢产物中的尿素,原理如图。
(1)电源的负极为________(填“A”或“B”)。
(2)阳极室中发生的反应依次为___________________________________、
___________________________________________________________。
(3)电解结束后,阴极室溶液的pH与电解前相比将________;若两极共收集到气体13.44 L(标准状况),则除去的尿素为________g(忽略气体的溶解)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
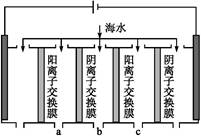
海洋资源的开发与利用具有广阔的前景。海水的pH一般在7.5~8.6之间。某地海水中主要离子的含量如下表:
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | S | HC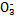 |
| 含量/(mg·L-1) | 9 360 | 83 | 200 | 1 100 | 16 000 | 1 200 | 118 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
钠及其化合物具有广泛的用途。 (1)工业上可利用反应Na(1)+ KCl(1) K(g)+ NaCl(1)来治炼金属钾,此反应利用了钠的还原性及___ _____,
(1)工业上可利用反应Na(1)+ KCl(1) K(g)+ NaCl(1)来治炼金属钾,此反应利用了钠的还原性及___ _____,
写出钠与TiCl4反应冶炼Ti的化学方程式______________ _______。
(2)用Na2CO3熔融盐作电解质,CO、O2为原料组成的新型电池的研究取得了重大突破。该电池示意图如图:
负极电极反应式为________________,为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环。A物质的化学式为______________。
(3)Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是
LiAlCl4-SOCl2。电池的总反应可表示为: 4Li + 2SOCl2 =4LiCl + S + SO2。
请回答下列问题:
①电池的负极材料为 ,发生的电极反应为 ;
②电池正极发生的电极反应为 ;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com