
 ,B的结构简式
,B的结构简式 或
或 .
. ,反应类型:取代反应.
,反应类型:取代反应.分析 (1)A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平,则A为CH2=CH2,B是一种比水轻的油状液态烃,0.1mol该烃在足量的氧气中完全燃烧,生成0.6mol CO2和0.3mol水,该烃中N(C)=$\frac{0.6mol}{0.1mol}$=6、N(H)=$\frac{0.3mol×2}{0.1mol}$=6,故B的分子式为C6H6,B的相对分子质量为78,则12n+2n-6=78,解得n=6,所以B为苯,
(2)中与A相邻的同系物C使溴的四氯化碳溶液褪色,则C为CH2=CH-CH3;
(3)苯与浓硝酸在浓硫酸、加热条件下发生硝化反应生成硝基苯.
(4)等质量的烃完全燃烧,烃中H元素质量分数越大,消耗氧气越多.
解答 解:(1)A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平,则A为CH2=CH2,B是一种比水轻的油状液态烃,0.1mol该烃在足量的氧气中完全燃烧,生成0.6mol CO2和0.3mol水,该烃中N(C)=$\frac{0.6mol}{0.1mol}$=6、N(H)=$\frac{0.3mol×2}{0.1mol}$=6,故B的分子式为C6H6,B的相对分子质量为78,则12n+2n-6=78,解得n=6,所以B为苯,则:A的电子式为 ,B的结构简式为:
,B的结构简式为: 或
或  ,
,
故答案为: ;
; 或
或  ;
;
(2)A相邻的同系物C为CH2=CHCH3,使溴水褪色发生加成反应,该反应为:CH2=CHCH3+Br2→CH2BrCHBrCH3,
故答案为:CH2=CHCH3+Br2→CH2BrCHBrCH3;加成反应;
(3)B与浓H2SO4与浓HNO3在50-60℃反应的化学反应方程为: ,属于取代反应,
,属于取代反应,
故答案为: ;取代反应;
;取代反应;
(4)乙烯中H元素质量分数比苯中H元素质量分数大,故相同质量的乙烯、苯燃烧,乙烯消耗的氧气更多,即等质量的A、B完全燃烧时消耗O2的物质的量大小为:A>B,
故答案为:A>B.
点评 本题考查有机物的推断,题目难度中等,侧重对基础知识的考查,注意等质量的烃中H的质量分数越大,完全燃烧消耗氧气越大,明确常见有机物结构与性质为解答关键,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
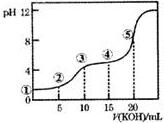 常温下,用0.10mol•L-1的KOH标准溶液滴定10.00mL0.10mol•L-1的H2C2O4(二元弱酸)溶液所得滴定曲线如图所示.下列说法正确的是( )
常温下,用0.10mol•L-1的KOH标准溶液滴定10.00mL0.10mol•L-1的H2C2O4(二元弱酸)溶液所得滴定曲线如图所示.下列说法正确的是( )| A. | 点①所示溶液中:c(H+)/c(OH-)=1012 | |
| B. | 点③所示溶液中:c(K+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-) | |
| C. | 点④所示溶液中:c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.1mol•L-1 | |
| D. | 点⑤所示溶液中:c(OH-)=c(H+)+c(HC2O4-)+c(H2C2O4) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24LSO3中硫原子数与1L0.1mol•L-1Na2SO3溶液中硫原子数相同 | |
| B. | 1mol•L-1FeCl3溶液全部制成胶体,其中含胶粒的数目小于NA | |
| C. | 1molNa2O2中含有NA个阴离子 | |
| D. | 1L0.5mol•L-1Na2SO4溶液中阴离子所带电荷数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | O=O | C=O | H=O | C=H |
| E/(kJ mol-1) | 496 | 799 | 460 | ? |
 |  |  |
| 图1 | 图2 | 图3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该混合溶液中有:c(Na+)+c(H+)=c(HC2O4-)+c (OH-)+2 c (C2O42-) | |
| B. | 该混合溶液中有:c (Na+)=2 (c(HC2O4-)+c (H2C2O4)+c (C2O42-)) | |
| C. | 该混合溶液中有:c (OH-)-c(H+)=c(HC2O4-)+2 c (H2C2O4) | |
| D. | 该混合溶液中有:c (Na+)>c (C2O42-)>c(HC2O4-)>c (OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com