
【题目】已知钍![]() 的原子可发生下列放射性变化:
的原子可发生下列放射性变化: ![]() →
→![]() +
+ ![]()
A. X的氢氧化物是一种强碱 B. X元素位于第六周期
C. X的碳酸盐难溶于水 D. X的最高化台价为+2价
【答案】B
【解析】A、根据原子序数为88可判断X是与Mg同主族的一种元素的原子,同一主族元素,金属性随着原子序数的增大而增强,金属性越强,其相应的碱的碱性越强,X的金属性大于它前边的金属(同一主族的金属),所以X的氢氧化物的碱性大于它前边的金属的氢氧化物(同一主族的金属),氢氧化钡是强碱,所以X的氢氧化物是一种强碱,A正确;B、X原子核外有7个电子层,X元素位于第七周期,B错误;C、根据元素周期律,同一主族元素及其化合物具有相似性,第二主族元素的碳酸镁、碳酸钡不溶于水,所以X的碳酸正盐难溶于水,C正确;D、主族元素的最高化合价与其族序数相等,X、Mg属第二主族的元素,最高化合价为+2价,D正确;答案选D。


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】查尔酮是一种重要的化工原料,可以通过如下过程合成。请回答下列有关问题:

(1)已知A的分子式为C8H10,它的结构简式为_______。查尔酮的结构属于烯烃的_____ (填“顺式”或“反式”)异构。
(2) B转化成C的反应类刑属于________;C分子中含氧官能团为______。
(3)D物质在OH-存在时与苯甲醛反应的化学方程式为___________。
(4) D的同分异构体中,属于芳香醛的有_____种;其中核磁共振氢谱吸收峰种类最少的一种同分异构体的名称为________。
(5)参照上述合成路线,写出由CH3CH=CH2制取丙酮的流程图:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生的实验报告所列出的下列数据中合理的是( )
A. 用10mL量筒量取8.16mL稀盐酸
B. 用托盘天平称量25.20g NaCl
C. 用广泛pH试纸测得某溶液的pH为2.3
D. 用25mL碱式滴定管进行中和滴定时,用去某浓度的碱溶液21.70mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生物冶金技术越来越受到科学家的重视,这项技术的关键之一是寻找一些特殊的酶。下列有关叙述错误的是( )
A.酶是一种蛋白质
B.酶只有在强酸性或弱碱性条件下才能发挥作用
C.酶的催化具有高效性、选择性和专一性
D.发展生物冶金技术有利于节约能源和保护环境
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中正确的是( )
A. 用规格为10mL的量筒量取6.20mL的液体
B. 称量氢氧化钠固体的质量时,将称量物放在滤纸上,并置于托盘天平的左盘,砝码放在托盘天平的右盘
C. 利用蒸馏可除去液态混合物中沸点不同的易挥发、难挥发或不挥发的杂质
D. 用四氯化碳萃取碘水中的碘,充分静置后紫红色液体在上层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一反应:2A+B![]() 2C,其中A、B、C均为气体,如图中的曲线是该反应在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有a、b、c三点,则下列描述正确的是( )
2C,其中A、B、C均为气体,如图中的曲线是该反应在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有a、b、c三点,则下列描述正确的是( )

A.该反应是放热反应
B.b点时混合气体的平均摩尔质量不再变化
C.T1温度下若由a点达到平衡,可以采取增大压强的方法
D.c点v正<v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.工业上有一种用CO2来生产甲醇燃料的方法:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1
CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1
将6 mol CO2和8 mol H2充入2 L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线)。图中数据a(1,6)表示:在1 min时H2的物质的量是6 mol。
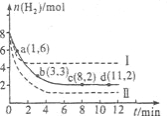
(1)a点正反应速率 (填“大于”“等于”或“小于”)逆反应速率。计算其化学平衡常数K=
(2)下列时间段平均反应速率最大的是
A.O~1 min B.1~3 min C.3~8 min D.8~11 min
(3)仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图中虚线所示。曲线I对应的实验条件改变是 ,曲线Ⅱ对应的实验条件改变是 。
(4)锰酸锂、钛酸锂都是绿色环保新型能源材料,可以用MnO2为原料制取锰酸锂。
①以石墨为电极,电解酸化的MnSO4溶液可制备MnO2,则阳极的电极反应式为 。
②MnO2是碱性锌锰电池的正极材料.碱性锌锰电池放电时,正极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证卤素单质氧化性的相对强弱,某小组用如图所示装置进行实验(夹持、加热仪器已略去,气密性已检验)。
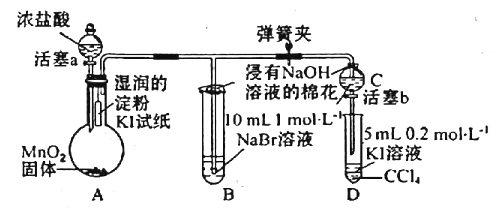
实验过程;
I.打开弹簧夹,打开活塞a,清加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕色时,关闭活塞a。
Ⅳ……
(1)A中产生的是黄绿色气体,其离子方程式为_________________,在该反应中浓盐酸表现了____性。
(2)验证氯气的氧化性强于碘的实验现象是____________________。
(3)B中溶液发生反应的离子方程式是____________________。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是____________________。
(5)浸有NaOH溶液的棉花作用是____;离子方程式为____________________。
(6)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下____,得电子能力逐渐减弱。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com