
| A、纯铁 | B、生铁 | C、无法确定 |
科目:高中化学 来源: 题型:
 上的碳原子分别称为伯碳、仲碳、叔碳、季碳原子,数目分别用n1、n2、n3、n4表示.例如:2,3,4,4-四甲基己烷.即:
上的碳原子分别称为伯碳、仲碳、叔碳、季碳原子,数目分别用n1、n2、n3、n4表示.例如:2,3,4,4-四甲基己烷.即: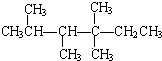 中n1=6,n2=1,n3=2,n4=1.根据不同烷烃的组成和结构,可分析出烷烃(除CH4外)中各原子数的关系.
中n1=6,n2=1,n3=2,n4=1.根据不同烷烃的组成和结构,可分析出烷烃(除CH4外)中各原子数的关系.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、选用有效的催化剂能增大正反应速率并提高SO2的转化率 | ||
| B、增大反应体系的压强,反应速率不一定增大 | ||
| C、该反应是放热反应,降低温度将缩短反应达到平衡的时间 | ||
D、在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为v=
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠和冷水反应 Na+2H2O=Na++2OH-+H2↑ |
| B、金属铝溶于氢氧化钠溶液 Al+2OH-=AlO2-+H2↑ |
| C、金属铝溶于盐酸中 2Al+6H+=2Al3++3H2↑ |
| D、铁跟稀硫酸反应 2Fe+6H+=2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.8mol |
| B、1.6mol |
| C、2mol |
| D、4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
 常温下,在没有氧气存在时,铁与水几乎不反应,但高温下,铁能与水蒸气发生反应,为了验证反应产物,长郡中学化学兴趣小组的同学进行了下述实验:
常温下,在没有氧气存在时,铁与水几乎不反应,但高温下,铁能与水蒸气发生反应,为了验证反应产物,长郡中学化学兴趣小组的同学进行了下述实验:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com