
| A. | 1 L溶液中含阴、阳离子总数是0.6 NA | |
| B. | 500 mL溶液中Ba2+的浓度是0.2 mol•L-1 | |
| C. | 500 mL溶液中NO-3的浓度是0.4 mol•L-1 | |
| D. | 1 L溶液中含有0.2 NA个NO3- |
分析 A、求出Ba(NO3)2的物质的量,而1molBa(NO3)2中含3mol离子;
B.离子的浓度与溶液的体积无关;
C.离子的浓度与溶液的体积无关;
D.求出Ba(NO3)2的物质的量,而1molBa(NO3)2中含2molNO3-.
解答 解:A、1L溶液中Ba(NO3)2的物质的量n=CV=0.2mol/L×1L=0.2mol,而1molBa(NO3)2中含3mol离子,故0.2molBa(NO3)2中含0.6mol离子,含阴、阳离子总数是0.6NA,故A正确;
B.离子的浓度与溶液的体积无关,故0.2mol/LBa(NO3)2溶液中Ba2+的浓度为0.2mol/L,故B正确;
C.离子的浓度与溶液的体积无关,故0.2mol/LBa(NO3)2溶液中NO3-的浓度为0.4mol/L,故C正确;
D.1LBa(NO3)2的物质的量n=CV=0.2mol/L×1L=0.2mol,而1molBa(NO3)2中含2molNO3-,故0.2molBa(NO3)2中含0.4molNO3-,故D错误;
故选D.
点评 本题考查了物质的量浓度的含义、微粒物质的量和浓度的计算应用,掌握基础是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热△H=-890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+$\frac{3}{2}$O2(g)=CO(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| B. | 中和热测定实验中的终止温度就是实验过程中混合液的最高温度 | |
| C. | 为了减少大气中的雾霾,天然气日渐成为一种备受关注的可再生的清洁能源 | |
| D. | 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 浓硫酸(H2SO4)500mL | |
| 浓度(质量分数) | 98% |
| 密度 | 1.81g•cm-3 |
| 相对分子质量 | 98 |
| 强腐蚀性,阴冷,密封贮藏 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
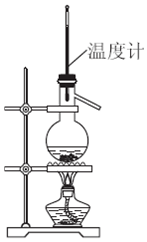
| A. | 制取乙烯 | |
| B. | 制取氯气 | |
| C. | 分离乙醇和水 | |
| D. | 分离水和碘的四氯化碳(常压下沸点76.8℃)溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 在通常情况下氯气比空气重 | |
| B. | 点燃是使氯气和氢气化合的唯一条件 | |
| C. | 氯气跟铁反应生成FeCl2 | |
| D. | 将红热的铜放入氯气中生成蓝色氯化铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
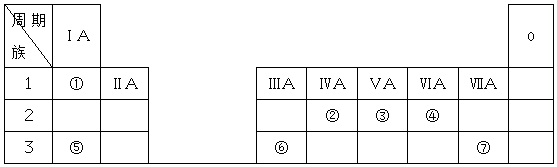
| A. | Y的最简单氢化物比R的稳定,Y的最简单氢化物沸点比R的高 | |
| B. | X与Y形成的两种化合物中阴、阳离子的个数比均为1:2 | |
| C. | Z、W、R最高价氧化物对应水化物的酸性强弱顺序:R>W>Z | |
| D. | Y与Z两种元素组成常见ZY2型分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com