

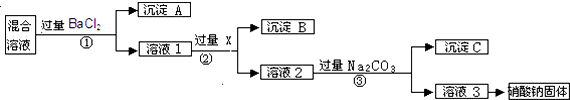
 .
. 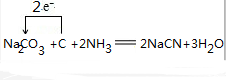 .
.
分析 (1)NaCN是有剧毒的药品,据此选择;
(2)NaCN属于离子化合物,钠离子直接用离子符号表示,阴离子需要标出所带电荷及最外层电子;
(3)根据元素守恒可知,纯碱、焦炭、氨气反应制取 NaCN,同时会生成水,根据化合价的变化确定电子转化方向和数目;
(4)以NaCN溶液在自然环境中浸取粉碎的含金(Au)矿石,得到 Na[Au(CN)2](二氰合金酸钠)溶液,再用锌还原 Na[Au(CN)2]生成金,根据元素的化合价的变化可知,NaCN中各元素的化合价没有变,是空气中的氧气氧化了金,根据电子得失守恒可计算出消耗的锌与生成的金的物质的量之比;
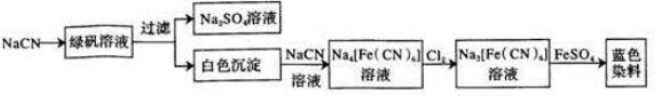
(5)根据工业流程可知,NaCN与FeSO4反应生成Fe(CN)2白色沉淀,Fe(CN)2继续与NaCN溶液反应生成Na4[Fe(CN)6],Na4[Fe(CN)6]被氯气氧化成Na3[Fe(CN)6],Na3[Fe(CN)6]与硫酸亚铁反应生成蓝色染料为Fe3[Fe(CN)6]2,据此答题;
(6)根据${K}_{h}=\frac{c(HCN)c(OH{\;}^{-})}{c(CN{\;}^{-})}$计算出水解平衡常数,比较NaCN的水解平衡常数和HCN的电离平衡常数可判断溶液的酸碱性.
解答 解:(1)NaCN是有剧毒的药品,应贴在装有氰化钠容器上的是剧毒标志,故选A;
(2)NaCN为离子化合物,电子式为 ,故答案为:
,故答案为: ;
;
(3)根据元素守恒可知,纯碱、焦炭、氨气反应制取 NaCN,同时会生成水,反应的化学方程式,并用单线桥标明电 子转移的方向和数目为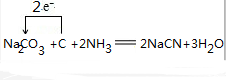 ,
,
故答案为: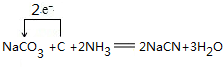 ;
;
(4)根据题意可知,NaCN溶液与Au以及空气中的氧气反应,Na[Au(CN)2]( 二氰合金酸钠)溶液,反应的化学方程式为4Au+8NaCN+2H2 O+O2=4Na[Au(CN)2]+4NaOH,所以氧化剂是氧气,还原1mol金要转移1mol电子,而每mol锌能转移2mol电子,所以消耗的锌与生成的金的物质的量之比为1:2,
故答案为:氧气;1:2;
(5)根据工业流程可知,NaCN与FeSO4反应生成Fe(CN)2白色沉淀,Fe(CN)2继续与NaCN溶液反应生成Na4[Fe(CN)6],Na4[Fe(CN)6]被氯气氧化成Na3[Fe(CN)6],反应的离子方程式为2[Fe(CN)6]4-+Cl2=2[Fe(CN)6]3-+2Cl-,Na3[Fe(CN)6]与硫酸亚铁反应生成蓝色染料为Fe3[Fe(CN)6]2,
故答案为:2[Fe(CN)6]4-+Cl2=2[Fe(CN)6]3-+2Cl-;Fe3[Fe(CN)6]2;
(6)根据${K}_{h}=\frac{c(HCN)c(OH{\;}^{-})}{c(CN{\;}^{-})}$可知,${K}_{h}=\frac{c(HCN)c(OH{\;}^{-})}{c(CN{\;}^{-})}$=$\frac{c(HCN)•c(OH{\;}^{-})•c(H{\;}^{+})}{c(CN{\;}^{-})•c(H{\;}^{+})}$=$\frac{K{\;}_{W}}{K{\;}_{a}}$=$\frac{1×10{\;}^{-14}}{6.2×10{\;}^{-10}}$=1.6×10-5>6.2×10-10,即水解平衡常数大于电离平衡常数,所以溶液呈碱性,
故答案为:碱;${K}_{h}=\frac{c(HCN)c(OH{\;}^{-})}{c(CN{\;}^{-})}$=$\frac{c(HCN)•c(OH{\;}^{-})•c(H{\;}^{+})}{c(CN{\;}^{-})•c(H{\;}^{+})}$=$\frac{K{\;}_{W}}{K{\;}_{a}}$=$\frac{1×10{\;}^{-14}}{6.2×10{\;}^{-10}}$=1.6×10-5>6.2×10-10;
点评 本题考查物质的制备实验方案的设计,侧重于学生的分析能力、实验能力和计算能力的考查,为高考常见题型,注意根据流程图把握实验的原理和操作方法,注意运用电子守恒进行计算,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(l);△H=-142.9kJ/mol | B. | 2H2(g)+O2(g)═2H2O(l);△H=-571.6kJ/mol | ||
| C. | 2H2+O2═2H2O;△H=-571.6kJ/mol | D. | 2H2(g)+O2(g)═2H2O(l);△H=+571.6kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2的氧化性比Fe3+强,其还原性比Fe2+强 | |
| B. | 在该实验中,最终溶液仍为无色 | |
| C. | 在该实验中,Fe2+和Fe3+总量保持不变 | |
| D. | H2O2值能的电子,不能失电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水、氨水的溶质分别是次氯酸、一水合氨 | |
| B. | 25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| C. | 物质溶于水时,不一定发生化学键的断裂 | |
| D. | 烧碱、冰醋酸、四氯化碳均为电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 发生的化学反应是复分解反应 | |
| B. | 反应的生成物中有Na2CO3 | |
| C. | 反应后形成的混合物的聚集颗粒直径为1~100nm | |
| D. | 反应说明硅酸易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
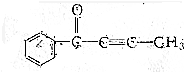 的有机化合物分子中:
的有机化合物分子中:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
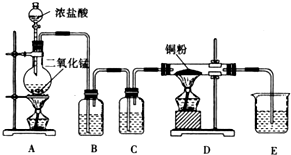 某实验学习小组用MnO2和浓盐酸制取纯净干燥的氯气,并让氯气与铜粉反应制取纯净的无水CuCl2,装置如图所示.
某实验学习小组用MnO2和浓盐酸制取纯净干燥的氯气,并让氯气与铜粉反应制取纯净的无水CuCl2,装置如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com