
��8�֣�ij�о�С�������������о���
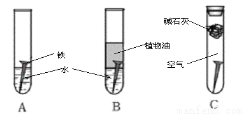
��1�������ϳ�ʱ���ͬѧ�۲쵽�������ǣ���ͼ�е������������������ (����ĸ)��
��2������ʵ�������жϣ�����������ʴ�����У������ĵ缫��ӦΪ�� ��
��3����Ϊ�˷�ֹ�������⣬��С��ͬѧ���������������һ��������ý�������ǣ� ��
A. �� B. ͭ C. п
��4����������ʴ����ҵ�����г���Ը������С�����������������Ч�������������ĸ�ʴ����ν���������������ڸ�������Ƚ�������������ʹ������γ�һ�����ܵ�����ɫ����Ĥ�������������̿ɱ�ʾ���£�
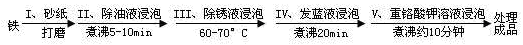
Ϊ���龭������������������Ƿ�ϸ�����Ʒ�������5%������ͭ��Һ�������Ʒ���ϸ�����������С�ɿף�δ�γ����ܵ�����Ĥ����һ��ʱ�佫�۲쵽������Ϊ__________________________��
��8��,ÿ��2�֣�
��1��A ��2��O2��2 H2O��4e���� 4 OH��
��3��C ��4������Ʒ�����к�ɫ��������
��������
�����������1����������ҪO2��H2O������A���������������⡣
��2��H2OΪ���ԣ�������������ʱ������Ӧ����ʽΪ��O2��2 H2O��4e���� 4 OH��
��3��Ϊ��ֹ�����⣬Ӧ������������ϵĽ����Ļ����Դ��������γ�ԭ���ʱ��������������������C����ȷ��
��4�������Ʒ���ϸ���������ͭ��Һ�Ӵ���������������ͭ���û���Ӧ������ͭ����������������һ��ʱ�佫�۲쵽������Ϊ������Ʒ�����к�ɫ����������
���㣺���⿼��ԭ���ԭ�����������ԭ�������ķ�����


 Сѧ���AB��ϵ�д�
Сѧ���AB��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014�߿���ʦ�Ƽ���ѧ--Ԥ��11 ���ͣ�ѡ����
�����£���20.00 mL 0.100 mol��L��1 CH3COONa��Һ����μ���0.100 0 mol��L��1���ᣬ��Һ��pH��������������Ĺ�ϵ����ͼ��ʾ(�����ǻӷ�)������˵����ȷ����
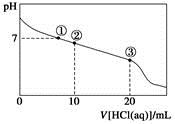
A�������ʾ��Һ�У�c(CH3COOH)��c(Cl��)��c(OH��)��c(H��)
B�������ʾ��Һ�У�c(Na��)��c(Cl��)��c(CH3COO��)��c(CH3COOH)
C�������ʾ��Һ�У�c(CH3COOH)��c(Na��)��c(H��)��c(CH3COO��)
D�����������п��ܳ��֣�c(H��)��c(Na��)��c(CH3COOH)��c(CH3COO��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ʦ�Ƽ���ѧ--Ԥ�� ���ͣ�ѡ����
����ʱ�����и���������ָ����Һ�п��Դ����������
A����ˮ�������c(H��)��10��12mol/L����Һ�У�Na����Ba2����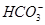 ��Cl��
��Cl��
B����ɫ����Һ�У�K����Cu2����SO42-��Na��
C�����д���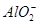 ����Һ�У�Na����OH����Cl����
����Һ�У�Na����OH����Cl����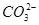
D����ʹpH��ֽ�Ժ�ɫ����Һ�У�Na����ClO����Fe2����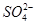
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ʦ�Ƽ���ѧ--�����ۺ�3 ���ͣ������
������(CH3OCH3)��һ����Ҫ�����ȼ�������䴢�ˡ�ȼ�հ�ȫ�ԡ�����ȼ���¶ȵ�����ָ�������Һ��ʯ������Ҳ������ȼ�յ�ص�ȼ�ϣ����кܺõĺ�չǰ����
��1����֪H2��CO��CH3OCH3��ȼ����(��H)�ֱ�Ϊ-285.5kJ/mol��-283kJ/mol��-1460.0 kJ/mol����ҵ������ˮú���ɷְ�1:1�ϳɶ����ѵ��Ȼ�ѧ����ʽΪ�� ��
��2����ҵ�ϲ��õ縡Զ���۷�������ˮʱ��������ˮ��pH��5.0��ͨ���������Fe(OH)3���壬�������������ʣ�ͬʱ��������������H2�������������ˮ�棬���ڳ�ȥ��ʵ�����Զ�����ȼ�ϵ��ģ��÷�����Ƶ�װ������ͼ��ʾ��
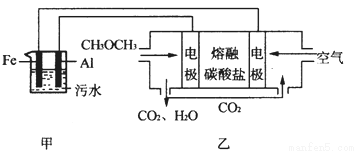
����װ��������̼����Ϊ����ʣ�ϡ����������Ϊ�缫��д����ȼ�ϵ�ص������缫��Ӧʽ ���������ʿ������������̼���ε��� ��
A.MgCO3 B.Na2CO3 C.NaHCO3 D.(NH4)2CO3
��д����װ��������������������Fe(OH)3���������ӷ���ʽ ��
����֪������Ksp[Fe(OH)3]=4.0��10-38�����һ��ʱ���װ����c(Fe3+)= ��
����֪��H2S�ĵ���ƽ�ⳣ����K1=9.1��10-8��K2=1.1��10-12��H2CO3�ĵ���ƽ�ⳣ����K1=4.31��10-7��K2=5.61��10-11����õ缫��ת�Ƶ���Ϊ0.24molʱ������װ�������ɵ�CO2ͨ��200mL 0.2mol/L��Na2S��Һ��,����ѡ����ȷ����
A��������Ӧ�����ӷ���ʽΪ��CO2+S2-+H2O=CO32-+H2S
B��������Ӧ�����ӷ���ʽΪ��CO2+S2-+H2O=HCO3-+HS-
C��c(Na+)=2[c(H2S)+c(HS-)+c(S2-)]
D��c(Na+)+c(H+)=2c(CO32-)+2c(S2-)+c(OH-)
E��c(Na+)>c(HCO3-)>c(HS-)>c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ʦ�Ƽ���ѧ--�����ۺ�1 ���ͣ������
A��B��C��DΪԭ������������������ֶ�����Ԫ�أ������ʻ�ṹ ��Ϣ���±���
��Ϣ���±���

�Իش���������
��1��B�����ڱ��е�λ���� ��B���⻯����E���⻯��Ƚϣ��е�ϸߵ��� ���ѧʽ������ˮ���ܽ�Ƚϴ���� ���ѧʽ��
��2��д��D3B���Ӧ������Һ�� ������ԡ��������ԡ������ԡ�����ԭ���ǣ��û�ѧ����ʽ��ʾ�� ��
��3��д�����ĵ���ʽΪ ��˵������ˮ��Һ�ڷ��ù����������Ի���ǿ��ԭ�������ӷ���ʽ��ʾ�� ��
��4����A��B��C��D����Ԫ���е�����Ԫ����ɵ�һ���ζ�����������Ȼ������ƣ�����ˮ��Һ�ʼ��ԡ������������Ȼ��Ƶ��Լ���
A�������͵��۵Ļ��Һ B��AgNO3��Һ
C�������Լ� D��ϡ����
��5����������ͭ˿���붡��Һ�У�û�������������������ữ����ӦѸ�ٷ�����ͭ˿�����ܽ���������ɫ��Һ��д���÷�Ӧ�����ӷ���ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014������Ϫһ�С�������ѧ���ݰ�һ�и�һ��ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
���������к���CO��CO2��SO2��H2O�����壬�â���ˮCuSO4���ڳ���ʯ��ˮ�ۺ���CuO������ʯ�ҡ���Ʒ����Һ�������Ը��������Һ��ҩƷ�ɽ���һһ��������ʱ��������ͨ��ҩƷ����ȷ˳����(����)
A���٢ݢڢ٢ܢ� B���٢ݢޢڢܢ�
C���ۢܢڢޢݢ� D���ڢݢ٢ܢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014������Ϫһ�С�������ѧ���ݰ�һ�и�һ��ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪����1 mol C��H����Ҫ��������414.4 kJ������1 mol C��C����Ҫ��������347.4 kJ������1 mol C===C������ų�����615.3 kJ������1 mol H��H������ų�����435.3 kJ��ij�л���ֽ�ķ�Ӧ�ɱ�ʾΪ��
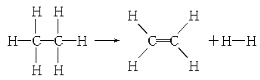
���ڷ�Ӧ��������1 mol����(��Ӧ��)�����йظ÷�Ӧ��˵����ȷ����(����)
A���÷�Ӧ�ų�251.2 kJ������ B���÷�Ӧ����251.2 kJ������
C���÷�Ӧ�ų�125.6 kJ������ D���÷�Ӧ����125.6 kJ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014���ճ����и߶���ѧ��ĩģ��4������2��ѡ��4���ṹ���Ծ��������棩 ���ͣ�ѡ����
������Ԫ�ؼס��ҡ���������Ԫ�����ڱ������λ�����±���ʾ�����м���̬�⻯���ˮ��Һ�ʼ��ԣ��������ж���ȷ����
�� | �� |
|
| �� | �� |
A����λ��Ԫ�����ڱ��е�2���ڡ��ڢ�A��
B��ԭ�Ӱ뾶���ף���
C�����ʵ������ԣ�������
D����̬�⻯���ȶ��ԣ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014��߿���ѧ³�ư�4.1�衡���ǽ���������ϰ���������棩 ���ͣ�ѡ����
�����뻯ѧ������أ����ж�Ӧ��ϵ�������(����)��
ѡ�� | ���� | ��Ҫ��ѧ�ɷ� |
A | �����ʯ | ���������� |
B | ����ʯ��ʯ��ʯ | ̼��� |
C | ��ͨˮ�ࡢ��ͨ���� | ������ |
D | ɳ�ӡ�ʯӢ | �������� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com