
| A. | 胶体是纯净物,氢氧化铁胶体带正电 | |
| B. | 胶体与溶液的本质区别是有丁达尔效应 | |
| C. | 将饱和氯化铁溶液滴入稀氢氧化钠溶液中加热,可得氢氧化铁胶体 | |
| D. | 胶体属于介稳体系 |
分析 A.胶体为分散系属于混合物,.氢氧化铁胶体不带电,氢氧化铁胶粒带正电;
B.胶体的分散质微粒直径大小是胶体区别于其它分散系的本质特征所在;
C.饱和氯化铁溶液与稀氢氧化钠溶液反应氢氧化铁沉淀;
D.胶体是一种均一、介稳定的分散系.
解答 解:A.胶体是分散质在分散剂中选出的混合物,氢氧化铁胶体为电中性,氢氧化铁胶粒吸附带正电的离子,故A错误;
B.胶体区别于其它分散系的本质是胶体分散质微粒直径的大小,不是有丁达尔效应,故B错误;
C.将饱和氯化铁溶液滴入稀氢氧化钠溶液中加热,可得氢氧化铁沉淀,故C错误;
D.胶体较稳定,静止不容易产生沉淀,属于介稳体系,故D正确.
故选D.
点评 本题考查胶体的性质,题目难度不大,注意氢氧化铁胶体的制备方法和实验步骤,注意反应的条件应用和试剂的选择,试剂的滴加顺序.


 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 质量数为12的碳原子符号:${\;}_{12}^{12}$C | |
| B. | 氧原子的结构示意图: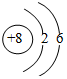 | |
| C. | CO2分子的电子式: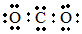 | |
| D. | 乙炔的结构简式:CH2=CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苏打--NaHCO3 | B. | 醋酸--C2H5OH | C. | 明矾-KAl(SO4)2 | D. | 生石灰-CaO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蚊虫叮咬处涂抹肥皂水可止痛痒 | |
| B. | 大力实施矿物燃料脱硫脱硝技术,能减少硫、氮氧化物的排放 | |
| C. | 明矾净水时发生了化学及物理变化,能起到净水作用,而没有杀菌、消毒的作用 | |
| D. | 铝合金的大量使用归功于人们能用焦炭等还原剂从氧化铝中获取铝单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ①②③⑤ | C. | ①②④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| I1 | I2 | I3 | I4 | I5 | |
| 电离能/(kJ•mol-1) | 738 | 1451 | 7733 | 10 540 | 13 630 |
| 离子晶体 | NaCl | KC1 | CaO |
| 晶格能/(kJ•mol-1) | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
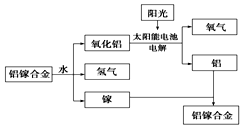 美国普度大学研究开发出一种利用铝镓合金制备氢气的新工艺(如图所示).下列有关该工艺的说法错误的是( )
美国普度大学研究开发出一种利用铝镓合金制备氢气的新工艺(如图所示).下列有关该工艺的说法错误的是( )| A. | 铝镓合金与水反应的化学方程式为2Al+3H2O$\frac{\underline{\;一定条件\;}}{\;}$Al2O3+3H2↑ | |
| B. | 总反应式为2H2O$\frac{\underline{\;一定条件\;}}{\;}$2H2↑+O2↑ | |
| C. | 该过程中,能量的转化形式只有两种 | |
| D. | 铝镓合金可以循环使用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com