
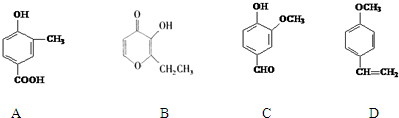
 ;
; .
. 分析 (1)A中含有羟基和羧基;根据其结构简式推断分子式;
(2)苯环、羰基为平面结构,直接相连的原子共面;化合物C中含6种H;
(3)D中只有碳碳双键与溴水生加成反应;
(4)D中含碳碳双键,可发生加聚反应;
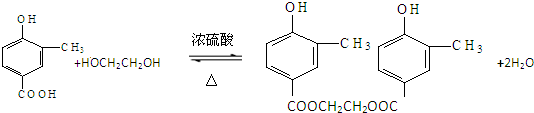
(5)A 中含有一个羧基,乙二醇中含有2个羟基,所以A与乙二醇以物质的量2:1反应生成一种酯,根据方程式的书写规则书写,注意要写可逆号.
解答 解:(1)A中含有的官能团的名称是羟基和羧基,化合物B的分子式是C7H8O3,故答案为:羟基、羧基;C7H8O3;
(2)苯环、羰基为平面结构,直接相连的原子共面,则共8个C原子共面;化合物C中含6种H,化合物C的核磁共振氢谱中出现6组峰,
故答案为:8;6;
(3)1mol D只有碳碳双键与溴水发生加成反应,1:1发生加成反应,所以共Br21mol,故答案为:1;
(4)D中含碳碳双键,在一定条件下发生加聚反应的化学方程式为 ,
,
故答案为: ;
;
(5)A 中含有一个羧基,乙二醇中含有2个羟基,所以A与乙二醇以物质的量2:1反应生成一种酯,反应方程式为: ,
,
故答案为: .
.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 1.0 | B. | 2.0 | C. | 3.0 | D. | 4.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在同温同压时,相同体积的任何气体单质所含的原子数目相同 | |
| B. | 2g氢气所含原子数目为NA | |
| C. | 在常温常压下,11.2L氮气所含原子数目为NA | |
| D. | 标准状况下,22.4L氧气所含原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示.
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示.| 步骤① | 配制1mol•L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管B中,加热A. |
| 步骤② | 往5mL1mol•L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色.微热3min,溶液颜色变为浅绿色. |
| 步骤③ | 往5mL重新配制的1mol•L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色.几分钟后,发现溶液颜色变成浅绿色. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2+H2O═H2CO3 | B. | NH4HCO3═CO2↑+H2O+NH3↑ | ||
| C. | Zn+H2SO4═H2↑+ZnSO4 | D. | Cu(OH)2+2HCl═CuCl2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 发展公交更有利于环保节油 | B. | 发展私人汽车更有利于环保节油 | ||
| C. | 发展公交不利于保持好身材 | D. | 发展私人汽车不利于“互联网+” |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com