
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
 下面给出了四种烃A、B、C、D的相关信息:
下面给出了四种烃A、B、C、D的相关信息:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,B元素名称为钾;
,B元素名称为钾;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清透明溶液中:Fe3+、Ba2+、Na+、Cl- | |
| B. | 使甲基橙呈红色的溶液中:NH4+、Ba2+、AlO2-、Cl- | |
| C. | 加入KSCN溶液显红色的溶液中:K+、NH4+、Cl-、I- | |
| D. | pH=13的无色溶液中:K+、NO3-、HCO3-、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | OH- | B. | SO${\;}_{4}^{2-}$ | C. | Ba2+ | D. | Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 约5mL | B. | 约10mL | C. | 约30mL | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
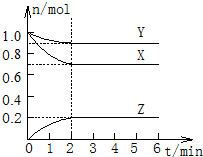 在一定温度下,体积为2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.根据图中数据,完成下列填空:
在一定温度下,体积为2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.根据图中数据,完成下列填空:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com