

| ||
| ||
| ||
| ||


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
| A、铅蓄电池在放电过程中,负极质量减小,正极质量增加 | ||
B、原子核内有10个中子的氧原子
| ||
| C、铜锌原电池工作时,电子沿外电路从铜电极流向锌电极 | ||
| D、新制饱和氯水在光照下有气泡产生,其主要成分是氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 起始物质的量 | 甲 | 乙 | 丙 |
| n(H2O)/mol | 0.10 | 0.20 | 0.20 |
| n(CO)/mol | 0.10 | 0.10 | 0.20 |
| A、甲容器中平均反应速率v(CO)与乙容器中平均反应速率v(CO)相同 |
| B、该反应的平衡常数表达式为K=c(CO) c(H2O)/c(CO2) c(H2) |
| C、平衡时,甲容器中CO的转化率与丙容器中CO的转化率相同 |
| D、平衡时,乙中c(H2O)是甲中的2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
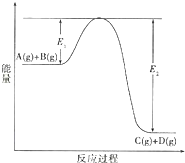 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、称取7.68g硫酸铜,加入500ml水 |
| B、称取12.0 g胆矾配成500ml的溶液 |
| C、称取12.5g胆矾配成500ml的溶液 |
| D、称取12.5g硫酸铜,加入500ml水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
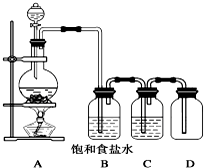 用下列装置制取并收集纯净的氯气,试回答下列问题:
用下列装置制取并收集纯净的氯气,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
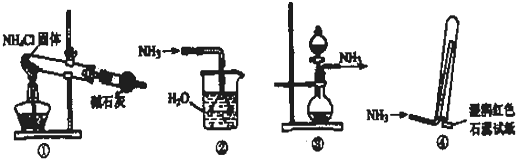
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com