
使1mol 乙烯与氯气完全反应发生加成反应,后使该加成反应的产物与足量氯气在光照的条件下发生取代反应,则两个过程中消耗的氯气的总的物质的量是
A.3mol B.4mol C.5mol D.6mol
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源:2015-2016学年广西桂林十八学高二下期中化学试卷(解析版) 题型:选择题
对于合成氨反应,达到平衡后,以下分析正确的是( )
A.升高温度,对正反应的反应速率影响更大
B.增大压强,对正反应的反应速率影响更大
C.减小反应物浓度,对逆反应的反应速率影响更大
D.加入催化剂,对逆反应的反应速率影响更大
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北黄冈中学高一下期中化学试卷(解析版) 题型:填空题
A、B、C、D都是短周期元素,原子半径D>C>A>B,其中A、B处在同一周期,A、C处在同一主族。C原子核内质子数等于A、B原子核内质子数之和,C原子最外层上的电子数是D原子最外层电子数的4倍。试回答:
(1)这四种元素名称分别是:A___________,B___________,C___________,D___________。
(2)这四种元素中在常温常压下的液态或气态氢化物的稳定性由大而小的顺序是_______________。(用化学式表示,下同)
(3)A与B形成的三原子分子的电子式是___________,B与D形成的原子个数比为l∶l的化合物中含有的化学键类型有___________。
(4)写一个能证明A和C的金属性或者非金属性强弱的化学方程式是___________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北黄冈中学高一下期中化学试卷(解析版) 题型:选择题
下列有关元素周期表说法中,正确的是( )
A.所有主族元素正化合价数,等于它的族序数
B.ⅦA族元素的原子随核电荷数的增加,得电予能力逐渐减弱
C.IA、IIA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
D.前三周期元素中共有非金属元素12种
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南师大附中高一5月月考化学试卷(解析版) 题型:选择题
物质甲是一种重要的有机化工原料,其结构简式为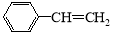 ,它一般不可能具有的性质是
,它一般不可能具有的性质是
A.易溶于水,不易溶于有机溶剂
B.在空气中燃烧产生黑烟
C.能使溴的四氯化碳溶液褪色
D.能发生加成反应在一定条件下可与4倍物质的量的氢气加成
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高一6月月考化学试卷(解析版) 题型:推断题
工业上可以用石油或淀粉作原料生产乙醇。
(1)用石油作原料生产乙醇的一系列反应如下图所示
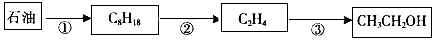
选择一种合适的试剂,完成反应③的化学方程式___________________________。
(2)用淀粉为原料生产乙醇,需经水解.发酵等过程。写出水解.发酵涉及的化学方程式(提示:发酵过程中有CO2放出)______________________________________________。
(3)乙醇跟乙酸在浓硫酸存在并加热的条件下发生酯化反应(反应A),其逆反应是水解反应(反应B)。反应可能经历了生成中间体(I),如图所示。在A~F 6个反应中,属于取代反应的是______________(填字母,下同);属于加成反应的是______________。
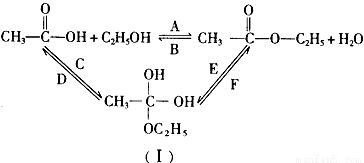
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高一6月月考化学试卷(解析版) 题型:选择题
A、B两种烃,它们含碳质量分数相同,下列关于A和B的叙述正确的是
A.A和B一定是同分异构体 B.A和B不可能是同系物
C.A和B最简式一定相同 D.A和B的化学性质相似
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西金溪一中高一下第二次月考化学试卷(解析版) 题型:简答题
(一)已知断裂1mol C—H键,要吸收热量414.4 kJ;断裂1 mol C—C键,要吸收热量347.4 kJ;生成1 mol C===C键,会放出热量615.3 kJ;生成1 mol H—H键,会放出热量435.3 kJ。某有机物分解的反应可表示为:

若在反应中消耗了1 mol乙烷,则有关该反应的说法正确的是
A.该反应放出251.2 kJ的热量
B.该反应吸收251.2 kJ的热量
C.该反应放出125.6 kJ的热量
D.该反应吸收125.6 kJ的热量
(二)如图所示的原电池,一段时间后某极析出1.28g的固体。回答下列问题:
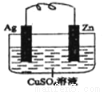
(1)正极是 (填“锌”或“银”),发生了 反应。
(2)正极的电极反应为 。
(3)上述过程中共转移电子 mol。
(4)锌片的质量 (填“增加”或“减少”) g。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆一中高一下学期期中化学试卷(解析版) 题型:实验题
氧化铁是重要工业颜料,以废铁屑为原料制备氧化铁的步骤如下:(部分操作和条件略)
步骤1:用碳酸钠溶液洗去铁屑表 面的油污。
面的油污。
步骤2:加入稍过量的稀硫酸,保持50~80℃,充分反应后,过滤。
步骤3:将滤液与稍过量的NH4HCO3溶液混合,得到FeCO3的浊液。
步骤4: 、 、 ,得到FeCO3固体。
步骤5:煅烧FeCO3,得到Fe2O3固体。
(1)步骤2中,如何判断反应已经充分? 。
(2)步骤2所得的滤渣中主要含有一种铁的化合物W(Fe3C),经以下处理后,回收利用:W在足量的空气中高温煅烧,生成有磁性的固体X;将X溶于稀硫酸。
①煅烧时1 mol W消耗O2 mol。
②X溶于稀硫酸的离子方程式为 。
(3)步骤3生成FeCO3反应的化学方程式为 。
(4)将步骤4补充完整: 、 、 。
(5)若煅烧时条件控制不当,会使产品中存在杂质FeO。
①若要设计实验检验产品中是否存在FeO,且只能选用两种试剂,这两种试剂是 。
②现煅烧116.0 kg的FeCO3,得到79.2 kg产品,则该产品的纯度为__________。(设产品中只有一种杂质FeO,计算结果保留3位有效数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com