
分析 (1)金属钠和水反应生成氢氧化钠和氢气,氧化钠与水反应生成氢氧化钠,根据氢气的质量计算未被氧化的金属钠的质量,并求得被氧化钠的质量;
(2)根据钠和氧化钠的质量,利用方程式可计算出氢氧化钠的质量,并求得其浓度;
(3)据2Al+2NaOH+2H2O=2NaAlO2+3H2↑此方程式中NaOH的量,并求铝的量;
解答 解:(1)金属钠和水反应生成氢氧化钠和氢气,氧化钠与水反应生成氢氧化钠,设10.8g反应物中含金属钠的质量为x,生成氢氧化钠的质量为y,
2Na+2H2O=2NaOH+H2↑
23×2 2 1
x y $\frac{4.48L}{22.4L/mol}$
则:x=9.2g,y=0.4mol,
m(Na2O)=12.3-9.2=3.1g
根据钠元素守恒:2Na~Na2O
46 62
m 3.1
则:m=2.3g
答:被氧化的金属钠的质量为2.3g;
(2)Na2O+H2O=2NaOH
62 2
3.1g b
则:b=0.1mol
n(NaOH)=y+b=0.4+0.1=0.5mol
c(NaOH)=$\frac{0.5mol}{0.1L}$=5mol/L
答:所得溶液的浓度为5mol/L;
(3)2Al+2NaOH+2H2O=2NaAlO2+3H2↑
54 2
m(Al) 0.5
则:m( Al)=13.5g
答:能溶解13.5克铝.
点评 本题考查了有关钠及其化合物的混合物反应的计算,题目难度中等,掌握钠的性质以及明确发生反应的实质为解答关键,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的分析、理解能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
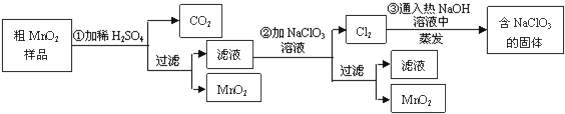
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A>B>E>D | B. | A>B>D>E | C. | D>A>B>E | D. | D>E>A>B |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入盐酸酸化的BaCl2溶液有白色沉淀产生,证明原溶液中肯定存在SO42- | |
| B. | 某无色气体,通入氧气后出现红棕色气体,证明原气体中肯定存在NO | |
| C. | 加NaOH溶液,加热,若生成的气体能使湿润的红色石蕊试纸变蓝,证明原溶液中肯定存在NH4+ | |
| D. | 加入AgNO3溶液和稀硝酸有黄色沉淀产生,证明原溶液中肯定存在I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
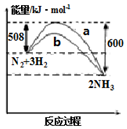
| A. | 该反应的热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=92kJ•mol-1 | |
| B. | b曲线是升高温度时的能量变化曲线 | |
| C. | 加入催化剂,该化学反应的活化能和反应热都改变 | |
| D. | 在温度体积一定的条件下,通入lmol N2和3molH2 反应后放出的热量为Q1kJ,若通入2mol N2和6mol H2 反应后放出的热量为Q2kJ,则184>Q2>2Q1 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
 钴及其化合物可作为一些化学合成的催化剂,亦用于油漆、颜料、玻璃、釉瓷及电极板等的制造.
钴及其化合物可作为一些化学合成的催化剂,亦用于油漆、颜料、玻璃、釉瓷及电极板等的制造.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mo lCl2参加反应转移电子数一定为2NA | |
| B. | 一定条件下,足量铜与200g98%的浓硫敌充分反应,转移电子数为2NA | |
| C. | 300mL 2mol/L蔗糖溶液中所含蔗糖分子数为0.6NA | |
| D. | 标准状况下,22.4L氦气与22.4L氟气所含原子数均为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com