
已知:CO(g)+H2O(g)CO2(g)+H2(g) ΔH=Q,其平衡常数随温度变化如下表所示:
| 温度/℃ | 400 | 500 | 850 |
| 平衡常数 | 9.94 | 9 | 1 |
请回答下列问题:
(1)上述反应的化学平衡常数表达式为:________________。该反应的Q________________0(填“>”或“<”)。
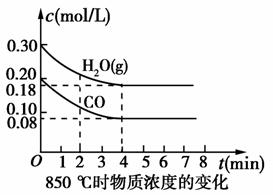
(2)850 ℃时在体积为10 L反应器中,通入一定量的CO和H2O(g),发生上述反应,CO和H2O(g)浓度变化如图所示,则0~4 min时平均反应速率v(CO)=________。
(3)若在500 ℃时进行,且CO、H2O(g)的起始浓度均为0.020 mol/L,该条件下,CO的最大转化率为________________。
(4)若在850 ℃时进行,设起始时CO和H2O(g)共为1 mol,其中水蒸气的体积分数为x,平衡时CO的转化率为y,试推导y随x变化的函数关系式为________________。
(5)某电化学装置可实现2CO2===2CO+O2的转化,使CO重复使用。已知该反应的阳极反应为4OH--4e-===2H2O+O2↑,则阴极反应式为________________。
(6)有人提出可以设计反应2CO===2C+O2(ΔH>0)来消除CO的污染。请判断上述反应能否自发进行:________________(填“可能”或“不可能”),理由是________________。
解析:本题考查化学反应速率和化学平衡,意在考查考生解决化学问题的能力。(1)可逆反应CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数K=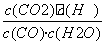 。由表中数据可知,温度越高,平衡常数越小,平衡向逆反应方向移动,因升高温度平衡向吸热方向移动,故正反应为放热反应。(2)由图像可知:CO在4 min内浓度减小了0.20 mol/L-0.08 mol/L=0.12 mol/L,则v(CO)=
。由表中数据可知,温度越高,平衡常数越小,平衡向逆反应方向移动,因升高温度平衡向吸热方向移动,故正反应为放热反应。(2)由图像可知:CO在4 min内浓度减小了0.20 mol/L-0.08 mol/L=0.12 mol/L,则v(CO)=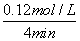 =0.03 mol/(L·min)。(3)500 ℃时平衡常数为9,设CO最多能转化x mol/L,则
=0.03 mol/(L·min)。(3)500 ℃时平衡常数为9,设CO最多能转化x mol/L,则
CO(g)+H2O(g)CO2(g)+H2(g)
起始(mol/L): 0.02 0.02 0 0
转化(mol/L): x x x x
平衡(mol/L): 0.02-x 0.02-x x x
则有: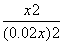 =9,解得x=0.015,则CO的最大转化率为
=9,解得x=0.015,则CO的最大转化率为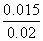 ×100%=75%。(4)850 ℃时平衡常数为1,有
×100%=75%。(4)850 ℃时平衡常数为1,有
CO(g) + H2O(g)CO2(g)+H2(g)
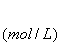 1-x x 0 0
1-x x 0 0
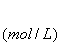 y(1-x) y(1-x) y(1-x) y(1-x)
y(1-x) y(1-x) y(1-x) y(1-x)
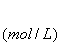 1-x-y+xy x-y+xy y(1-x) y(1-x)
1-x-y+xy x-y+xy y(1-x) y(1-x)
则有: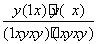 =1,解得y=x。(5)由于阴极发生还原反应,CO2被还原生成CO,则阴极反应为:2CO2+4e-+2H2O===2CO+4OH-。(6)由于反应2CO===2C+O2的ΔH>0,ΔS<0,则ΔG=ΔH-TΔS>0,反应是一个焓增、熵减的反应,任何情况下都不能自发进行。
=1,解得y=x。(5)由于阴极发生还原反应,CO2被还原生成CO,则阴极反应为:2CO2+4e-+2H2O===2CO+4OH-。(6)由于反应2CO===2C+O2的ΔH>0,ΔS<0,则ΔG=ΔH-TΔS>0,反应是一个焓增、熵减的反应,任何情况下都不能自发进行。
答案:(1)K==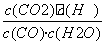 (1分) <(1分)
(1分) <(1分)
(2)0.03 mol/(L·min) (2分)
(3)75%(2分) (4)y=x(2分)
(5)2CO2+4e-+2H2O===2CO+4OH-(2分)
(6)不可能(1分) ΔH>0吸热且ΔS<0(或依据吉布斯自由能判断)(1分)


科目:高中化学 来源: 题型:
高温下,炽热的铁与水蒸气在一个体积可变的密闭容器中进行反应:
3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g),下列条件的改变对其反应速率几乎无影响的是 ( )
A.把铁块变成铁粉 B.将容器的体积缩小一半
C.压强不变,充入氮气使容器体积增大 D.体积不变,充入氮气使容器压强增大
查看答案和解析>>
科目:高中化学 来源: 题型:
下列热化学方程式书写正确的是(ΔH的绝对值均正确)( )
A.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(g)
ΔH=-1367.0 kJ·mol-1(燃烧热)
B.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l)
ΔH=+57.3 kJ·mol-1(中和热)
C.2NO2===O2+2NO
ΔH=+116.2 kJ·mol-1(反应热)
D.S(s)+O2(g)===SO2(g)
ΔH=-296.8 kJ·mol-1(反应热)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应X(g)+Y(g)nZ(g) ΔH>0,将X和Y以一定比例混合通入密闭容器中进行反应,各物质的浓度随时间的改变如图所示。下列说法不正确的是( )
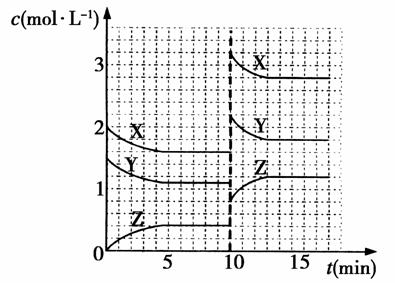
A.反应方程式中n=1
B.10 min时,曲线发生变化的原因是升高温度
C. 10 min时,曲线发生变化的原因是增大压强
D.0~5 min内,用X表示的反应速率为v(X)=0.08 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知同温同压下,下列反应的焓变和平衡常数分别表示为
(1)2SO2(g)+O2(g)2SO3(g)
ΔH1=-197 kJ·mol-1 K1=a
(2)2NO(g)+O2(g)2NO2(g)
ΔH2=-144 kJ·mol-1 K2=b
(3)NO2(g)+SO2(g)SO3(g)+NO(g)
ΔH3=-m kJ·mol-1 K3 =c
下列说法正确的是( )
A.m=53 c2=a/b B.m=-26.5 2c=a-b
C.m=-170.5 2c=a-b D.m=26.5 c2=a/b
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室模拟合成氨和氨催化氧化的流程如下:
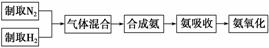
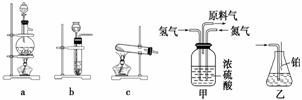
已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。
(1)从图中选择制取气体的合适装置:氮气__________________________________、
氢气______________。
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有________、 ________________________________。
(3)氨合成器出来经冷却的气体连续通入乙装置的水中吸收氨,________ (“会”或“不 会”)发生倒吸,原因是___________________________________________________
(“会”或“不 会”)发生倒吸,原因是___________________________________________________
________________________________________________________________________。
(4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是____________________________ _______________,
_______________,
锥形瓶中还可观察到的现象是_____________________________________________。
(5)写出乙装置中氨氧化的化学方程式:_____________________________________
____________________。
(6)反应结束后锥形瓶内的溶液中含有的离子为H+、OH-、________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
研究性学习小组对某硫酸亚铁晶体(FeSO4·xH2O)热分解研究,该小组同学称取a g硫酸亚铁晶体样品按图1高温加热,使其完全分解,对所得产物进行探究,并通过称量装置B质量测出x的值。

(1)装置B中硫酸铜粉末变蓝,质量增加12.6 g,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中还有________________。
(2)实验中要持续通入氮气,否则测出的x会_________ (填“偏大”、“偏小”或“不变”)。
(3)硫酸亚铁晶体完全分解后装置A中还残留红棕色固体Fe2O3。
(4)从理论上分析得出硫酸亚铁分解还生成另一物质SO3,写出FeSO4分解的化学方程式________________。
(5)装置D球形干燥管的作用________________。
(6)某研究所利用SDTQ600热分析仪对硫酸亚铁晶体(FeSO4·xH2O)进行热分解,获得相关数据,绘制成固体质量-分解温度的关系图如图2,根据图2中有关数据,可计算出FeSO4·xH2O中的x=________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com