
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
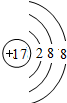 ,故答案为:Cl;
,故答案为:Cl; ;
;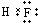 ;③的过氧化物是Na2O2,其电子式为
;③的过氧化物是Na2O2,其电子式为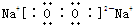 ,故答案为:
,故答案为: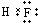 ;
;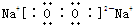 ;
;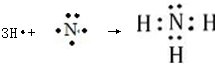 ,故答案为:
,故答案为: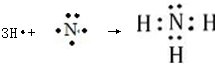 .
.


科目:高中化学 来源: 题型:
| A、64g SO2中含有的氧原子数为2NA |
| B、含有6.02×1023个H原子的H2在标准状况下的体积约为22.4L |
| C、40g NaOH溶解在1L水中,所制得的溶液,物质的量浓度为1mol?L-1 |
| D、标准状况下,11.2L H2O含有的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某课外小组用如图所示装置进行实验.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.查阅资料发现,高铁酸根
某课外小组用如图所示装置进行实验.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.查阅资料发现,高铁酸根查看答案和解析>>
科目:高中化学 来源: 题型:
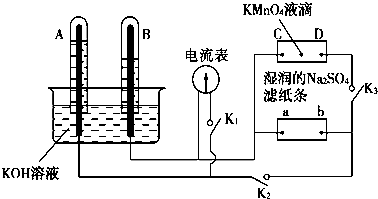
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH4、C2H4 |
| B、CH3CH2OH、CH3COOH |
| C、C2H6、HCHO |
| D、HCOOH、CH3COOCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、P3>P4,y轴表示C的体积分数 |
| B、P3<P4,y轴表示B的质量分数 |
| C、P3<P4,y轴表示混合气体的密度 |
| D、P3>P4,y轴表示混合气体的平均摩尔质量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com