
| A、漂白粉是纯净物,漂白液是混合物 |
| B、漂白粉的有效成分是CaClO2 |
| C、工业上将氯气通入石灰乳中制取漂白粉 |
| D、漂白液的有效成分是Na2O2 |


 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源: 题型:
| A、稀盐酸 |
| B、氯化钡溶液 |
| C、硝酸银溶液 |
| D、氢氧化钠浓溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
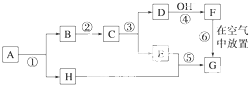
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③④⑤ | B、②③④ |
| C、①③④ | D、①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
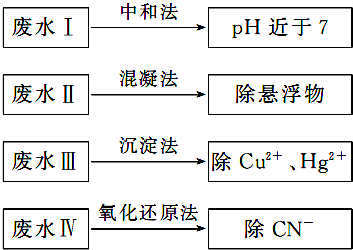
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、BaSO4的溶度积常数比BaCO3的小 |
| B、S没有毒性,C有毒性 |
| C、BaSO4的密度大 |
| D、胃酸能与CO32-结合,生成CO2和H2O,使BaCO3的溶解平衡向右移动,Ba2+浓度增大,造成人体Ba2+中毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| 5n(NO)(mol) | 0.020 | 0.010 | 0.006 | 0.004 | 0.004 | 0.004 |
查看答案和解析>>
科目:高中化学 来源: 题型:
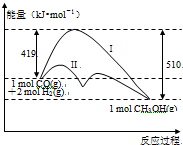 反应CO(g)+2H2(g)?CH3OH(g)过程中的能量变化情况如图所示,曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况.下列判断正确的是( )
反应CO(g)+2H2(g)?CH3OH(g)过程中的能量变化情况如图所示,曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况.下列判断正确的是( )| A、该反应的△H=+91 kJ/mol |
| B、加入催化剂,该反应的△H变小 |
| C、如果该反应生成液态CH3OH,则△H变大 |
| D、反应物的总能量大于生成物的总能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com