
| A、AgNO3 |
| B、H2O |
| C、NaCl |
| D、Na2SO4 |
| ||


科目:高中化学 来源: 题型:
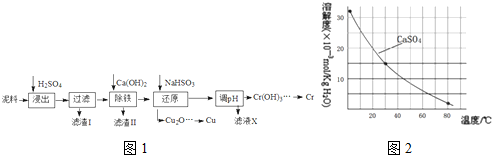
| Fe3+ | Cu2+ | Cr3+ | |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |
查看答案和解析>>
科目:高中化学 来源: 题型:
| +X一定条件 |
| 反应① |
| +X一定条件 |
| 反应② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液仍为紫色 |
| B、最终溶液褪色,而无其它现象 |
| C、溶液最终变蓝色 |
| D、溶液中有气泡产生,溶液最终变为无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 | B、3 | C、4 | D、5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 酸 | HClO4 | H2SO4 | HCl | HNO3 |
| Ka | 1.6×10-5 | Ka1:6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
| A、温度对这四种酸在冰醋酸中的电离常数无影响 |
| B、在冰醋酸中HClO4是这四种酸中最强的酸 |
| C、在冰醋酸中H2SO4的电离方程式为H2SO4?2H++SO42- |
| D、这四种酸在冰醋酸中都没有完全电离,所以均属于弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H+、Cl-、Na+、CO32- |
| B、Na+、Ag+、Cl-、NO3- |
| C、Cu2+、Mg2+、SO42-、Cl- |
| D、H+、Na+、Cl-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
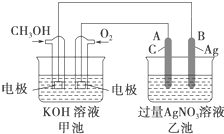 如图是一个化学过程的示意图.已知甲池的总反应式为2CH3OH+3O2+4KOH═2K2CO3+6H2O
如图是一个化学过程的示意图.已知甲池的总反应式为2CH3OH+3O2+4KOH═2K2CO3+6H2O查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com