
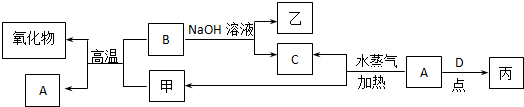
| ||
| ||


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
| A、放热反应在任何条件都能自发进行 |
| B、应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| C、任何能使熵值增大的过程都能自发进行 |
| D、△H>0,△S<0的化学反应一定能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲苯能使酸性高锰酸钾溶液褪色,而甲基环己烷不能使酸性高锰酸钾褪色 |
| B、乙烯能与溴水发生加成反应,而乙烷不能发生加成反应 |
| C、苯酚与溴水可直接反应,而苯与液溴反应则需要铁作催化剂 |
| D、苯与硝酸在加热时发生取代反应,甲苯与硝酸在常温下就能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、能电离出H+的物质不一定是酸 |
| B、蔗糖、碳酸钡和水分别属于非电解质、强电解质和弱电解质 |
| C、根据分散系中分散质粒子直径大小将分散系分为溶液、胶体和浊液 |
| D、焰色反应是化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com