
ΓΨΧβΡΩΓΩ¬»Τχ «“Μ÷÷÷Ί“ΣΒΡΜ·ΙΛ‘≠ΝœΘ§‘ΎΙΛ≈©“Β…ζ≤ζΓΔ…ζΜν÷–”–Ή≈÷Ί“ΣΒΡ”Π”ΟΓΘ Β―ι “÷Τ»Γ¬»Τχ≥ΐΝΥ”Ο≈®―ΈΥαΚΆΕΰ―θΜ·ΟΧΆβΜΙΩ…“‘άϊ”Οœ¬Ν–Ζ¥”ΠΘΚKClO3+6HCl(≈®)=KCl+3Cl2Γϋ+3H2O,ΗΟΖ¥”ΠΒΡ”≈Βψ «Ζ¥”Π≤ζ…欻ΤχΥΌΕ»ΩλΓΔ≤Μ–η“ΣΦ”»»ΓΘ«κΡψΗυΨίΥυ―ß÷Σ ΕΜΊ¥πœ¬Ν–Έ Χβ
(1)ΗΟΖ¥”Π÷–―θΜ·≤ζΈο”κΜΙ‘≠≤ζΈοΒΡΈο÷ ΒΡΝΩ÷°±»ΈΣ_____________________ΓΘ
(2)Α―¬»ΤχΆ®»κΉœ…Ϊ ·»ο»ή“Κ÷–Θ§Ω…“‘Ιέ≤λΒΫΒΡœ÷œσ «________________________________ΓΘ
(3) Β―ι “≈δ÷ΤΚΟ2.0mol/L NaOH»ή“ΚΘ§–η“Σ’β÷÷»ή“Κ____________mL≤≈Ρή”κ4.48L¬»ΤχΘ®±ξΉΦΉ¥ΩωΘ©«ΓΚ≈Άξ»ΪΖ¥”ΠΓΘ
(4)“―÷ΣBr2ΒΡΥ°»ή“Κ“ρ≈®Ε»≤ΜΆ§Εχ≥ œ÷≥»…ΪΜρΚλΉΊ…ΪΘ§NaBr»ή“Κ÷–ΜΚΜΚΆ®»κCl2 ±Θ§Ω…“‘Ω¥ΒΫΈό…Ϊ»ή“Κ÷πΫΞ±δΈΣΚλΉΊ…ΪΘ§«κ–¥≥ωΕ‘”ΠΒΡάκΉ”ΖΫ≥Χ Ϋ_________________________________ΓΘ
(5)œ÷–η490mL 2.0mol/L NaOH»ή“ΚΘΚ
ΔΓΥυ–η≥ΤΝΩΒΡ«β―θΜ·ΡΤΙΧΧεΒΡ÷ ΝΩ «__________________ΓΘ
ΔΔ…œ ω Β―ι–η“ΣΒΡ“«Τς”–ΧλΤΫΘ®Κ§μά¬κΘ©ΓΔ“©≥ΉΓΔ…’±≠ΓΔΝΩΆ≤ΓΔ≤ΘΝßΑτΓΔΫΚΆΖΒΈΙήΓΔ______________ΓΘ
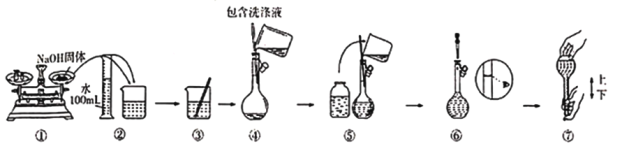
ΔΘΡ≥Ά§―ß≤ΩΖ÷≈δ÷ΤΙΐ≥Χ»γΆΦΥυ ΨΘ§Ρψ»œΈΣ”–¥μΈσΒΡ≤ΌΉς «_____________________ΘΜ»τΑ¥≤ΌΉςΥυ Ψ≥ΤΝΩ ±Θ§÷Η’κœρΉσΤΪΘ§‘ρΥυ≈δ»ή“Κ≈®Ε»ΫΪ____________________Θ®ΧνΓΑΤΪΗΏΓ±ΓΑΤΪΒΆΓ±ΜρΓΑ≤Μ±δΓ±Θ©
ΓΨ¥πΑΗΓΩ5ΓΟ1 œ»±δΚλΘ§ΚσΆ …Ϊ 200 Cl2ΘΪ2Br-ΘΫ2Cl-ΘΪBr2 40.0 g 500 mL»ίΝΩΤΩ ΔΌΔό ΤΪΒΆ
ΓΨΫβΈωΓΩ
Θ®1Θ©KClO3+6HCl =KCl+3Cl2Γϋ+3H2O÷–Θ§Cl‘ΣΥΊΒΡΜ·ΚœΦέ”…+5ΦέΫΒΒΆΈΣ0Θ§Cl‘ΣΥΊΒΡΜ·ΚœΦέ”…©¹1Φέ…ΐΗΏΈΣ0Θ§“‘¥Υά¥Ϋβ¥πΘΜ
Θ®2Θ©“άΨί¬»ΤχΚΆΥ°Ζ¥”Π…ζ≥…ΒΡ≤ζΈο―ΈΥαΚΆ¥Έ¬»Υα–‘÷ Ζ÷Έω≈–ΕœΘΜ
Θ®3Θ©nΘ®Cl2Θ©ΘΫ![]() ΘΫ0.2molΘ§ΗυΨίΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫCl2+2OH©¹ΘΫCIO©¹+Cl©¹+H2OΦΤΥψΘΜ
ΘΫ0.2molΘ§ΗυΨίΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫCl2+2OH©¹ΘΫCIO©¹+Cl©¹+H2OΦΤΥψΘΜ
Θ®4Θ©¬»Τχ”κδεΜ·ΡΤΖ¥”Π…ζ≥…¬»Μ·ΡΤΚΆδεΒΞ÷ ΘΜ
Θ®5Θ©ΔΓΗυΨίmΘΫnMΘΫcVMΦΤΥψΘΜΔΔΗυΨί≤ΌΉςΒΡ≤Ϋ÷η»ΖΕ®Υυ–η“«ΤςΘΜΔΘ≥ΤΝΩΒΡNaOHΙΧΧε ±”ΠΉσΈο”“¬κΘΜΕ®»ί ±”ΠΤΫ ”ΩΧΕ»œΏΘ§“άΨίcΘΫ![]() Ϋχ––Έσ≤νΖ÷ΈωΓΘ
Ϋχ––Έσ≤νΖ÷ΈωΓΘ
Θ®1Θ©KClO3+6HCl =KCl+3Cl2Γϋ+3H2O÷–Θ§1KClO3÷–Cl‘ΣΥΊΒΡΜ·ΚœΦέ”…+5ΦέΫΒΒΆΈΣ0Θ§‘ρ―θΜ·ΦΝΈΣKClO3Θ§5HCl÷–Cl‘ΣΥΊΒΡΜ·ΚœΦέ”…©¹1Φέ…ΐΗΏΈΣ0Θ§‘ρΜΙ‘≠ΦΝΈΣ5HClΘ§Υυ“‘―θΜ·≤ζΈο”κΜΙ‘≠≤ζΈοΒΡΈο÷ ΝΩ÷°±»ΈΣ5ΘΚ1Θ§Ι ¥πΑΗΈΣΘΚ5ΘΚ1ΘΜ
Θ®2Θ©¬»ΤχΆ®»κΉœ…Ϊ ·»ο ‘“Κ÷–ΚΆΥ°Ζ¥”Π…ζ≥…―ΈΥα Ι ·»ο±δΚλ…ΪΘ§…ζ≥…ΒΡ¥Έ¬»ΥαΨΏ”–Τ·ΑΉ–‘ ΙΚλ…ΪΆ »ΞΘ§Ι ¥πΑΗΈΣΘΚœ»±δΚλΘ§ΚσΆ …ΪΘΜ
Θ®3Θ©nΘ®Cl2Θ©ΘΫ![]() ΘΫ0.2molΘ§”…Ζ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫCl2+2OH©¹ΘΫCIO©¹+Cl©¹+H2OΩ…÷ΣnΘ®NaOHΘ©ΘΫ0.4molΘ§VΘ®NaOHΘ©ΘΫ
ΘΫ0.2molΘ§”…Ζ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫCl2+2OH©¹ΘΫCIO©¹+Cl©¹+H2OΩ…÷ΣnΘ®NaOHΘ©ΘΫ0.4molΘ§VΘ®NaOHΘ©ΘΫ![]() ΘΫ0.2LΘΫ200mLΘ§Ι ¥πΑΗΈΣΘΚ200ΘΜ
ΘΫ0.2LΘΫ200mLΘ§Ι ¥πΑΗΈΣΘΚ200ΘΜ
Θ®4Θ©¬»Τχ”κδεΜ·ΡΤΖ¥”Π…ζ≥…¬»Μ·ΡΤΚΆδεΒΞ÷ Θ§Ε‘”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣΘΚCl2+2Br©¹ΘΫ2Cl©¹+Br2ΘΜ
Ι ¥πΑΗΈΣΘΚCl2+2Br©¹ΘΫ2Cl©¹+Br2ΘΜ
Θ®5Θ©ΔΓœ÷–η490mL 2.0molL©¹1 NaOH»ή“ΚΘ§‘ρ―Γ”Ο500ml»ίΝΩΤΩΘ§Υυ“‘nΘ®NaOHΘ©ΘΫ0.5LΓΝ2mol/LΘΫ1molΘ§mΘ®NaOHΘ©ΘΫ1molΓΝ40g/molΘΫ40.0gΘ§Ι ¥πΑΗΈΣΘΚ40.0gΘΜ
ΔΔ≈δ÷ΤΥ≥–ρ «ΘΚΦΤΥψΓζ≥ΤΝΩΓζ»ήΫβΓΔά以Γζ“Τ“ΚΓζœ¥Β”ΓζΕ®»ίΓζ“Γ‘»ΓζΉΑΤΩΧυ«©Θ§“ΜΑψ”ΟΧλΤΫ≥ΤΝΩΘ®”ΟΒΫ“©≥ΉΘ©≥ΤΝΩΘ§‘Ύ…’±≠÷–»ήΫβΘ§ά以ΚσΉΣ“ΤΒΫ500mL»ίΝΩΤΩ÷–Θ§≤Δ”Ο≤ΘΝßΑτ“ΐΝςΘ§ΉΣ“ΤΆξ±œΘ§”Ο…ΌΝΩ’τΝσΥ°œ¥Β”…’±≠ΦΑ≤ΘΝßΑτ2ΓΪ3¥Έ≤ΔΫΪœ¥Β”“Κ»Ϊ≤ΩΉΣ“ΤΒΫ»ίΝΩΤΩ÷–Θ§‘ΌΦ” ΝΩ’τΝσΥ°Θ§Β±Φ”Υ°÷Ν“ΚΟφΨύάκΩΧΕ»œΏ1ΓΪ2cm ±Θ§ΗΡ”ΟΫΚΆΖΒΈΙήΒΈΦ”Θ§ Ι»ή“ΚΒΡΑΦ“ΚΟφΒΡΉνΒΆΒψ”κΩΧœΏœύΤΫΘ§»ϊΚΟΤΩ»ϊΘ§Ζ¥Η¥…œœ¬ΒΏΒΙ“Γ‘»ΓΘΥυ“‘–η“ΣΒΡ“«Τς”–Ά–≈ΧΧλΤΫΓΔ“©≥ΉΓΔ…’±≠ΓΔ≤ΘΝßΑτΓΔ500mL»ίΝΩΤΩΓΔΫΚΆΖΒΈΙήΘ§‘ρΜΙ–η“Σ500 mL»ίΝΩΤΩΘ§Ι ¥πΑΗΈΣΘΚ500 mL»ίΝΩΤΩΘΜ
ΔΘ≥ΤΝΩΒΡNaOHΙΧΧε ±”ΠΉσΈο”“¬κΘ§Ε®»ί ±”ΠΤΫ ”ΩΧΕ»œΏΘ§Υυ“‘”–¥μΈσΒΡ≤ΌΉς «ΔΌΔόΘ§»τΑ¥≤ΌΉςΥυ Ψ≥ΤΝΩ ±Θ§÷Η’κœρΉσΤΪΘ§‘ρ≥ΤΝΩΒΡNaOHΙΧΧεΤΪ–ΓΘ§ΗυΨίcΘΫ![]() Υυ≈δ»ή“Κ≈®Ε»ΫΪΤΪΒΆΘΜΙ ¥πΑΗΈΣΘΚΔΌΔόΘΜΤΪΒΆΓΘ
Υυ≈δ»ή“Κ≈®Ε»ΫΪΤΪΒΆΘΜΙ ¥πΑΗΈΣΘΚΔΌΔόΘΜΤΪΒΆΓΘ


 Ωλά÷–Γ≤© ΩΙ°ΙΧ”κΧαΗΏœΒΝ–¥πΑΗ
Ωλά÷–Γ≤© ΩΙ°ΙΧ”κΧαΗΏœΒΝ–¥πΑΗ
| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΡ≥―ß…ζ”Ο»γΆΦΉΑ÷ΟΫχ––COΚΆCO2ΜλΚœΤχΧεΒΡΖ÷άκΚΆΗ…‘οΓΘΤδ÷–aΈΣΒ·Μ…Φ–(ΩΊ÷ΤΤχΧεΆ®Ιΐ)Θ§bΈΣΖ÷“Κ¬©ΕΖΒΡΜν»ϊ(ΗΟΜν»ϊΉς”Ο «”Ο”ΎΩΊ÷ΤΖ÷“Κ¬©ΕΖΡΎ“ΚΧεΒΡΝς≥ω”κΖώ)ΓΘ
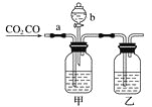
(1)¥”«β―θΜ·ΡΤΓΔœΓΝρΥαΓΔ≈®ΝρΥαΦΗ÷÷Έο÷ ÷–―Γ‘ώΚœ ΒΡΈο÷ Χν»κœ¬Ν–Ω’Ηώ÷–Θ§±ψΩ…¥οΒΫ Β―ιΡΩΒΡΘ§ΦΉΤΩΡΎ Δ________»ή“ΚΘ§““ΤΩΡΎ Δ________»ή“ΚΘ§Ζ÷“Κ¬©ΕΖΡΎ Δ________»ή“ΚΓΘ
(2) Β―ι ±œ»Ζ÷άκ≥ωCOΘ§ΖΫΖ® «œ»ΙΊ±’___(ΧνaΜρbΘ§œ¬Ά§)Θ§¥ρΩΣ___Θ§–¥≥ω¥Υ ±ΖΔ…ζΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΘΚ____ΓΘ
(3)Ζ÷άκΆξCOΚσΘ§‘Ό ’Φ·CO2Θ§ΖΫΖ® «œ»ΙΊ±’____Θ§‘Ό¥ρΩΣ____Θ§–¥≥ω¥Υ ±≤ζ…ζCO2Ζ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΘΚ__ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΡ≥―ß…ζ”Ο»γΆΦΉΑ÷ΟΫχ––COΚΆCO2ΜλΚœΤχΧεΒΡΖ÷άκΚΆΗ…‘οΓΘΤδ÷–aΈΣΒ·Μ…Φ–(ΩΊ÷ΤΤχΧεΆ®Ιΐ)Θ§bΈΣΖ÷“Κ¬©ΕΖΒΡΜν»ϊ(ΗΟΜν»ϊΉς”Ο «”Ο”ΎΩΊ÷ΤΖ÷“Κ¬©ΕΖΡΎ“ΚΧεΒΡΝς≥ω”κΖώ)ΓΘ
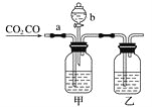
(1)¥”«β―θΜ·ΡΤΓΔœΓΝρΥαΓΔ≈®ΝρΥαΦΗ÷÷Έο÷ ÷–―Γ‘ώΚœ ΒΡΈο÷ Χν»κœ¬Ν–Ω’Ηώ÷–Θ§±ψΩ…¥οΒΫ Β―ιΡΩΒΡΘ§ΦΉΤΩΡΎ Δ________»ή“ΚΘ§““ΤΩΡΎ Δ________»ή“ΚΘ§Ζ÷“Κ¬©ΕΖΡΎ Δ________»ή“ΚΓΘ
(2) Β―ι ±œ»Ζ÷άκ≥ωCOΘ§ΖΫΖ® «œ»ΙΊ±’___(ΧνaΜρbΘ§œ¬Ά§)Θ§¥ρΩΣ___Θ§–¥≥ω¥Υ ±ΖΔ…ζΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΘΚ____ΓΘ
(3)Ζ÷άκΆξCOΚσΘ§‘Ό ’Φ·CO2Θ§ΖΫΖ® «œ»ΙΊ±’____Θ§‘Ό¥ρΩΣ____Θ§–¥≥ω¥Υ ±≤ζ…ζCO2Ζ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΘΚ__ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΕΧ÷ήΤΎ÷ςΉε‘ΣΥΊXΓΔYΓΔZΓΔWΒΡ‘≠Ή”–ρ ΐ“ά¥ΈΒί‘ωΘ§Τδ÷–Y”κZΆ§÷ςΉεΓΘX”κYΓΔZ”κWΨυΩ…–Έ≥…»γΆΦΥυ ΨΒΡΖ÷Ή”ΫαΙΙΘ§«“Z”κW–Έ≥…ΒΡΖ÷Ή”÷–Υυ”–‘≠Ή”ΉνΆβ≤ψΨυ¬ζΉψ8ΒγΉ”Έ»Ε®ΫαΙΙΓΘœ¬Ν–ΥΒΖ®÷–’ΐ»ΖΒΡ «Θ® Θ©
A.άκΉ”ΑκΨΕΘΚW>Z>Y>X
B.ZY2ΚΆWY2ΕΦΩ…“‘ ΙΤΖΚλ»ή“ΚΆ …ΪΒΪΆ …Ϊ‘≠άμ≤ΜΆ§
C.―θΜ·ΈοΕ‘”ΠΒΡΥ°Μ·ΈοΒΡΥα–‘ΘΚW>Z
D.X2Y2Θ§Z2W2ΨυΚ§”–Ζ«ΦΪ–‘Ι≤ΦέΦϋ«“Ης‘≠Ή”ΕΦ¬ζΉψ8ΒγΉ”ΒΡΈ»Ε®ΫαΙΙ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬Ν–άκΉ”ΖΫ≥Χ Ϋ ι–¥’ΐ»ΖΒΡ «Θ® Θ©
A.ΒβΜ·―«Χζ»ή“Κ÷–Ά®»κΙΐΝΩ¬»ΤχΘΚ2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
B.ΟςΖ·»ή“Κ÷–ΒΈ»κBa(OH)2»ή“Κ ΙSO42-«ΓΚΟΆξ»Ϊ≥ΝΒμΘΚ2Ba2++3OH-+Al3++2SO42-=2BaSO4Γΐ+Al(OH)3Γΐ
C.”ΟΆ≠ΉςΒγΦΪΒγΫβCuSO4»ή“ΚΘΚ2Cu2++2H2O![]() 2Cu+O2Γϋ+4H+
2Cu+O2Γϋ+4H+
D.1molL-1ΒΡNaAlO2»ή“ΚΚΆ2.5molL-1ΒΡHCl»ή“ΚΒ»ΧεΜΐΜΞœύΨυ‘»ΜλΚœΘΚ2AlO2-+5H+=Al3++Al(OH)3Γΐ+H2O
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΒΣΒΡΜ·ΚœΈο «‘λ≥…¥σΤχΈέ»ΨΒΡ÷ς“ΣΈο÷ ΓΘ―–ΨΩΒΣΒΡΜ·ΚœΈοΒΡΖ¥”ΠΜζάμΕ‘”Ύœϊ≥ΐΜΖΨ≥Έέ»Ψ”–÷Ί“Σ“β“εΓΘ
Θ®1Θ©NO‘ΎΩ’Τχ÷–¥φ‘Ύ»γœ¬Ζ¥”ΠΘΚ2NO(g)+O2(g)![]() 2NO2(g)ΓςHΘ§…œ ωΖ¥”ΠΖ÷ΝΫ≤ΫΆξ≥…Θ§ΤδΖ¥”Πάζ≥Χ»γΆΦΥυ ΨΘΚΜΊ¥πœ¬Ν–Έ ΧβΘΚ
2NO2(g)ΓςHΘ§…œ ωΖ¥”ΠΖ÷ΝΫ≤ΫΆξ≥…Θ§ΤδΖ¥”Πάζ≥Χ»γΆΦΥυ ΨΘΚΜΊ¥πœ¬Ν–Έ ΧβΘΚ
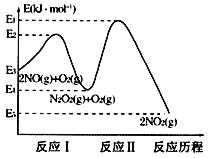
ΔΌ–¥≥ωΖ¥”ΠIΒΡ»»Μ·―ßΖΫ≥Χ Ϋ___ΓΘ
ΔΎΕ‘”ΎΉήΖ¥”ΠΘΚ2NO(g)+O2(g)![]() 2NO2(g)Θ§Ε‘ΗΟΖ¥”ΠΧεœΒ…ΐΗΏΈ¬Ε»ΖΔœ÷ΉήΖ¥”ΠΥΌ¬ Ζ¥Εχ±δ¬ΐΘ§Τδ‘≠“ρΩ…Ρή «__(Ζ¥”ΠΈ¥ Ι”Ο¥ΏΜ·ΦΝ)ΓΘ
2NO2(g)Θ§Ε‘ΗΟΖ¥”ΠΧεœΒ…ΐΗΏΈ¬Ε»ΖΔœ÷ΉήΖ¥”ΠΥΌ¬ Ζ¥Εχ±δ¬ΐΘ§Τδ‘≠“ρΩ…Ρή «__(Ζ¥”ΠΈ¥ Ι”Ο¥ΏΜ·ΦΝ)ΓΘ
Θ®2Θ©”ΟΫΙΧΩΜΙ‘≠NO2ΒΡΖ¥”ΠΈΣ2NO2(g)+2C(s)![]() N2(g)+2CO2(g)Θ§‘ΎΚψΈ¬ΧθΦΰœ¬Θ§1molNO2ΚΆΉψΝΩCΖΔ…ζΗΟΖ¥”ΠΘ§≤βΒΟΤΫΚβ ±NO2ΚΆCO2ΒΡΈο÷ ΒΡΝΩ≈®Ε»”κΤΫΚβΉή―ΙΒΡΙΊœΒ»γΆΦΥυ ΨΘΚ
N2(g)+2CO2(g)Θ§‘ΎΚψΈ¬ΧθΦΰœ¬Θ§1molNO2ΚΆΉψΝΩCΖΔ…ζΗΟΖ¥”ΠΘ§≤βΒΟΤΫΚβ ±NO2ΚΆCO2ΒΡΈο÷ ΒΡΝΩ≈®Ε»”κΤΫΚβΉή―ΙΒΡΙΊœΒ»γΆΦΥυ ΨΘΚ

ΔΌAΓΔBΝΫΒψΒΡ≈®Ε»ΤΫΚβ≥Θ ΐΙΊœΒΘΚKc(A)___Kc(B)(ΧνΓΑ<Γ±ΓΑ>Γ±ΜρΓΑ=Γ±)
ΔΎAΓΔBΓΔC»ΐΒψ÷–NO2ΒΡΉΣΜ·¬ ΉνΒΆΒΡ «___(ΧνΓΑAΓ±ΓΑBΓ±ΜρΓΑCΓ±)ΒψΓΘ
ΔέΦΤΥψCΒψ ±ΗΟΖ¥”ΠΒΡ―Ι«ΩΤΫΚβ≥Θ ΐKp(C)=___(Kp «”ΟΤΫΚβΖ÷―Ι¥ζΧφΤΫΚβ≈®Ε»ΦΤΥψ)
Θ®3Θ©ΒγΜ·―ßΤχΟτ¥ΪΗ–ΤςΩ…“‘Φύ≤βΩ’ΤχΜΖΨ≥÷–NH3ΒΡΚ§ΝΩΘ§‘≠άμ»γΆΦΥυ ΨΓΘΗΚΦΪΒΡΒγΦΪΖ¥”ΠΈΣ___Θ§ΦΌ…η”–16.8L(±ξΉΦΉ¥Ωω)ΒΡΑ±ΤχΫχ»κ¥ΪΗ–Τς≤Έ”κΖ¥”ΠΘ§Νμ“ΜΦΪ–η“ΣΆ®»κ±ξΉΦΉ¥Ωωœ¬O2ΒΡΧεΜΐΈΣ___ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩX(g)+3Y(g)![]() 2Z(g) ΓςH=-92kJ/molΘ§ΫΪ1mol XΚΆ3mol YΆ®»κ2LΒΡΚψ»ίΟή±’»ίΤς÷–Ϋχ––Ζ¥”ΠΘ§10min ±≤βΒΟYΒΡΈο÷ ΒΡΝΩΈΣ2.4molΓΘœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «
2Z(g) ΓςH=-92kJ/molΘ§ΫΪ1mol XΚΆ3mol YΆ®»κ2LΒΡΚψ»ίΟή±’»ίΤς÷–Ϋχ––Ζ¥”ΠΘ§10min ±≤βΒΟYΒΡΈο÷ ΒΡΝΩΈΣ2.4molΓΘœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «
A.10minΡΎΘ§XΒΡΤΫΨυΖ¥”ΠΥΌ¬ ΈΣ0.01mol/(LΓΛmin)
B.ΒΎ10min ±Θ§XΒΡΖ¥”ΠΥΌ¬ ΈΣ0.01mol/(LΓΛmin)
C.10minΡΎΘ§œϊΚΡ0.1mol XΘ§…ζ≥…0.4mol Z
D.10minΡΎΘ§XΚΆYΖ¥”ΠΖ≈≥ωΒΡ»»ΝΩΈΣ92kJ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ…ηNA±μ ΨΑΔΖϋΦ”Β¬¬ό≥Θ ΐΒΡ÷ΒΘ§œ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «Θ® Θ©
A.Β»ΧεΜΐΒΡCO2ΚΆCOΘ§Ζ÷Ή” ΐΡΩΨυΈΣNA
B.≥ΘΈ¬œ¬pH=12ΒΡNaOH»ή“Κ÷–Θ§Υ°Βγάκ≥ωΒΡ«βάκΉ” ΐΈΣ10-12NA
C.±ξΉΦΉ¥Ωωœ¬Θ§22.4LΒΡH2ΚΆ22.4LΒΡF2ΜλΚœΚσΘ§ΤχΧεΖ÷Ή” ΐΈΣ2NA
D.H2OΘ®gΘ©Ά®ΙΐΉψΝΩNa2O2Θ®sΘ©≥δΖ÷Ζ¥”ΠΘ§ΙΧΧε‘ω÷Ίbg ±Θ§Ζ¥”Π÷–ΉΣ“ΤΒΡΒγΉ” ΐΈΣbNA/2
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΈΣΧΫΨΩNa2O2”κH2OΒΡΖ¥”ΠΘ§Ϋχ––ΝΥ»γœ¬ Β―ιΘΚ
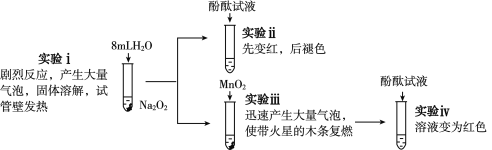
”–ΙΊΥΒΖ®≤Μ’ΐ»ΖΒΡ «Θ® Θ©
A. Β―ιΔΓ÷–ΖΔ…ζΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ2Na2O2+2H2O===4NaOH+O2Γϋ
B. Β―ιΔΘ÷–MnO2ΉωH2O2Ζ÷ΫβΖ¥”ΠΒΡ¥ΏΜ·ΦΝ
C.ΉέΚœ Β―ιΔΓΚΆΔΘΩ…“‘ΥΒΟςNa2O2”κH2OΖ¥”Π”–H2O2…ζ≥…
D.ΉέΚœ Β―ιΔΔΚΆΔΘΩ…“‘ΥΒΟς ΙΖ”ΧΣΆ …ΪΒΡ «O2
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΑΌΕ»÷¬–≈ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com