
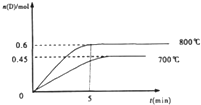
 2L�ݻ�������ܱ������У�����1.0molA��2.2molB���������·�Ӧ��A��g��+2B��g��?C��g��+D��g�����ڲ�ͬ�¶��£�D�����ʵ���n��D����ʱ��t�Ĺ�ϵ��ͼ���Իش��������⣺
2L�ݻ�������ܱ������У�����1.0molA��2.2molB���������·�Ӧ��A��g��+2B��g��?C��g��+D��g�����ڲ�ͬ�¶��£�D�����ʵ���n��D����ʱ��t�Ĺ�ϵ��ͼ���Իش��������⣺| ��c |
| ��t |
| c(C)?c(D) |
| c(A)?c2(B) |
| ��Ӧ����ʼ�����ʵ���-��Ӧ��ƽ������ʵ��� |
| ��Ӧ����ʼ�����ʵ��� |
| ��c |
| ��t |
| ||
| ��t |
| 0.3mol/L��0.3mol/L |
| 0.2mol/L��(0.5mol/L)2 |
| 1.2mol |
| 2.2mol |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�


 ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��ͬ���칹�壺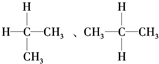 |
B��������CH4��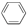 ��CH2�TCH2 ��CH2�TCH2 |
| C�����ࣺ�����ǡ����ǡ���ά�� |
| D������ᡢ���ᡢ��֬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��W��X��Y��Zԭ�ӵĺ����������������ܺ�Ϊ20 |
| B������W��X��YԪ�ص�ԭ�Ӱ뾶��СΪW��X��Y |
| C����W��X��ɵĻ�����ķе��ܵ�����W��Y��ɵĻ�����ķе� |
| D��W��Y���γɼȺ����Թ��ۼ��ֺ��Ǽ��Թ��ۼ��Ļ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 �����к͵ζ����ⶨij�ռ���Һ��Ũ�ȣ��й����ݼ�¼���£�
�����к͵ζ����ⶨij�ռ���Һ��Ũ�ȣ��й����ݼ�¼���£�| �ζ���� | ����Һ�����mL�� | �����������Һ�������mL�� | ||
| �ζ�ǰ | �ζ��� | ���ĵ�Һ�� | ||
| 1 | 25.00 | 0.50 | 26.80 | 26.30 |
| 2 | 25.00 | |||
| 3 | 25.00 | 5.00 | 31.34 | 26.34 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com