
已知常温下反应,①NH3+H+NH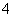 (平衡常数为K1),②Ag++Cl-AgCl(平衡常数为K2),③Ag++2NH3Ag(NH3)
(平衡常数为K1),②Ag++Cl-AgCl(平衡常数为K2),③Ag++2NH3Ag(NH3)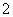 (平衡常数为K3)。①、②、③的平衡常数关系为K1>K3>K2,据此所做的以下推测合理的是( )
(平衡常数为K3)。①、②、③的平衡常数关系为K1>K3>K2,据此所做的以下推测合理的是( )
A.氯化银不溶于氨水
B.银氨溶液中加入少量氯化钠有白色沉淀
C.银氨溶液中加入盐酸有白色沉淀
D.银氨溶液可在酸性条件下稳定存在
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
下列解释事实的化学方程式或离子方程式不正确的是
A. 用食醋除去暖水瓶中的水垢:2CH3COOH + CaCO3 ═ Ca2+ + 2CH3COO- + CO2↑+ H2O
B. 自然界各种原生铜的硫化物经氧化、淋滤作用后产生的硫酸铜,遇到难溶的PbS,慢慢转变为铜蓝(CuS):Cu2+ + SO42- + PbS ═ CuS + PbSO4
C. 在盐碱地(含较多NaCl、Na2CO3)上通过施加适量CaSO4,可降低土壤的碱性:
CaSO4 + Na2CO3 ═ CaCO3↓+ Na2SO4
D. 在燃煤时加入适量石灰石,可减少SO2的排放: 2CaCO3 + O2 + 2SO2 ═ 2CaSO3 + 2CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
C、N、S是重要的非金属元素,按要求回答下列问题:
(1)烟道气中含有的CO和SO2是重要的污染物,可在催化剂作用下将它们转化为S(s)和CO2,此反应的热化学方程式为______________________________________。
已知:CO(g)+1/2O2(g)=CO2(g) △H=-283.0kJ·mol-1;
S(s)+O2=SO2(g) △H=-296.0 kJ·mol-1
(2)向甲、乙两个均为1L的密闭容器中,分别充入5mol SO2和3mol O2,发生反应:
2 SO2 (g)+O2 (g) 2SO3(g) △H<0。甲容器在温度为T1的条件下反应,达到平衡时SO3的物质的量为4.5mol;乙容器在温度为T2的条件下反应,达到平衡时SO3的物质的量为4.6mol。
2SO3(g) △H<0。甲容器在温度为T1的条件下反应,达到平衡时SO3的物质的量为4.5mol;乙容器在温度为T2的条件下反应,达到平衡时SO3的物质的量为4.6mol。
则T1________T2(填“>”“<”),甲容器中反应的平衡常数K=___________。
(3)如图所示,A是恒容的密闭容器,B是一个体积可变的充气气囊。保持恒温,关闭K2,分别将1 mol N2和3mol H2通过K1、K3充入A、B中,发生的反应为:
N2(g)+3H2(g)  2NH3(g),起始时A、B的体积相同均为a L。
2NH3(g),起始时A、B的体积相同均为a L。

①下列示意图正确,且既能说明A容器中反应达到平衡状态,又能说明B容器中反应达到平衡状态的是_ __。
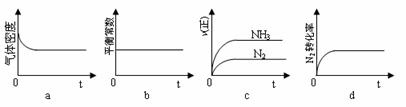
②容器A中反应到达平衡时所需时间t s,达到平衡后容器的压强变为原来的5/6,则平均反应速率v(H2)=____。
(4)将0.1mol氨气分别通入1L pH=1的盐酸、硫酸和醋酸溶液中,完全反应后三溶液中NH4+离子浓度分别为c1、c2、c3,则三者浓度大小的关系为_______ (用c1、c2、c3和>、<、=表示)。已知醋酸铵溶液呈中性,常温下CH3COOH的Ka=1×10-5 mol·L-1,则该温度下0.1 mol·L-1的NH4Cl溶液的pH为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
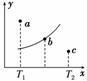 有一反应:2A+B2C,其中A、B、C均为气体,如图中的曲线是该反应在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有a、b、c三点,则下列描述正确的是( )
有一反应:2A+B2C,其中A、B、C均为气体,如图中的曲线是该反应在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有a、b、c三点,则下列描述正确的是( )
A.该反应是放热反应
B.b点时混合气体的平均摩尔质量不再变化
C.T1温度下若由a点达到平衡,可以采取增大压强的方法
D.c点v正<v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示表示两个常见的固氮反应:①N2+3H22NH3和②N2+O22NO的平衡常数(lg K)与温度的关系,根据图中的数据判断下列说法正确的是( )
A.反应②为放热反应
B.常温下,反应①的反应速率很大,而反应②的反应速率很小
C.升高温度,反应①的反应速率增大,反应②的反应速率减小
D.在常温下,利用反应①固氮和利用反应②固氮反应程度相差很大
查看答案和解析>>
科目:高中化学 来源: 题型:
氯碱工业电解所用的氯化钠溶液需精制。除去有影响的Ca2+、Mg2+、NH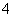 、SO
、SO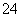 及泥沙,其精制流程如下:
及泥沙,其精制流程如下:
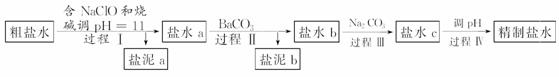 已知:①Ca2+、Mg2+开始形成相应氢氧化物沉淀的pH如下表。
已知:①Ca2+、Mg2+开始形成相应氢氧化物沉淀的pH如下表。
| Ca(OH)2 | Mg(OH)2 | |
| pH | ≥11.5 | ≥4.2 |
②Ksp(BaSO4)=1.1×10-10,Ksp(BaCO3)=2.6×10-9,Ksp(CaCO3)=5.0×10-9。
下列说法正确的是( )
A.盐泥a除泥沙外,还含有Ca(OH)2和Mg(OH)2
B.过程Ⅰ中将NH 转化为N2的离子方程式是3ClO-+2NH
转化为N2的离子方程式是3ClO-+2NH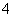 ===3Cl-+N2↑+3H2O+2H+
===3Cl-+N2↑+3H2O+2H+
C.过程Ⅱ中通入CO2有利于除SO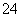
D.过程Ⅳ调pH可以使用硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
在反应X+2Y═R+M中,已知R和M的摩尔质量之比为22:9,当1.6gX与Y完全反应后,生成4.4gR,则此反应中Y和M的质量之比为()
| A. | 16:9 | B. | 32:9 | C. | 23:9 | D. | 46:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
常温常压下,由A、B组成的混合气体[Mr(A)>Mr(B)],经分析混合气体中只含碳和氧两种元素.A和B不论以何种比例混合,若碳氧质量比总大于 3:8,则 A1 为CO2,B1 为CO;
若碳氧质量比总小于 3:8,则A2 为CO2,B2 为O2.
若B1和B2常温混合后,碳氧质量比总小于 3:8时,B1、B2 必须满足的关系是 n(B1):n(B2)<.
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)Na3N是一种重要的化合物,是由 键形成的,其中两种粒子的半径关系是:Na+ N3-(填“>”、“=”或“<”)。
(2)已知R2+离子核外有a个电子,b个中子。表示R原子符号是 。
(3)在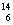 C、
C、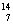 N、
N、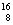 O、
O、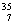 Cl、
Cl、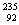 U、
U、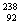 U中;互为同位素的是 。
U中;互为同位素的是 。
(4)原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
现有如下两个反应:A.NaOH+HCl=NaCl+H2O;B.Zn+H2SO4=ZnSO4+H2↑
判断能否设计成原电池A. ,B. 。(填“能”或“不能”)
若能,则请你写出构成原电池的负极电极反应式_________,正极电极反应式 。
(5)KOH的电子式:: ;NH4Cl中阴离子的电子式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com