
| A. | 汤姆生 | B. | 玻尔 | C. | 卢瑟福 | D. | 普朗克 |
分析 根据原子结构模型的演变可知:
(1)19世纪初,英国科学家道尔顿提出近代原子学说,他认为原子是微小的不可分割的实心球体;
(2)1897年,英国科学家汤姆生发现了电子.1904年提出“葡萄干面包式”的原子结构模型;
(3)1911年英国物理学家卢瑟福(汤姆生的学生)提出了带核的原子结构模型;
(4)1913年丹麦物理学家波尔(卢瑟福的学生)引入量子论观点,提出电子在一定轨道上运动的原子结构模型;
(5)奥地利物理学家薛定谔提出电子云模型(几率说).
解答 解:A.汤姆生发现了电子,提出“葡萄干面包式”的原子结构模型,故A错误;
B.波尔提出了量子论,故B错误;
C.卢瑟福(汤姆生的学生)提出了带核的原子结构模型,故C正确;
D.普朗克是物理学家,是量子力学的创始人,故D错误.
故选C.
点评 本题主要考查了化学史,难度不大,平时注意知识的积累.


 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:实验题
 某实验小组用0.50mol/L NaOH溶液和0.50mol/L H2SO4溶液进行中和热的测定:
某实验小组用0.50mol/L NaOH溶液和0.50mol/L H2SO4溶液进行中和热的测定:| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
| 实验次数 温度 | 起始温度t1/℃ | 终止温度t2/℃ | 平均温度差 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
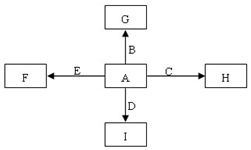 图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.已知:①反应C+G$\stackrel{高温}{→}$B+H能放出大量的热,该反应曾应用于铁轨的焊接;
图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.已知:①反应C+G$\stackrel{高温}{→}$B+H能放出大量的热,该反应曾应用于铁轨的焊接; ,它的空间构型是直线型;
,它的空间构型是直线型;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
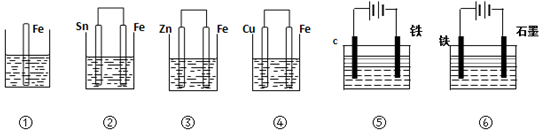
| A. | ④>②>①>③>⑤>⑥ | B. | ⑥>④>②>①>③>⑤ | C. | ④>②>⑤>③>⑥>① | D. | ⑥>③>②>④>①>⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用丁达尔效应可鉴别FeCl3溶液和Fe(OH)3胶体 | |
| B. | 在某未知成分的溶液中滴入足量盐酸,如观察到无色无味的气体产生,且能使澄清石灰水变浑浊,即证明溶液中必定有CO32- | |
| C. | 向某无色溶液中加入BaCl2溶液,有白色沉淀出现,再加入稀盐酸,沉淀不消失,无法证明溶液一定含有SO42- | |
| D. | 氨气能使湿润的红色石蕊试纸变蓝,说明氨气的水溶液呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Co2O3+6HCl=2CoCl2+Cl2↑+3H2O中,氧化剂和还原剂物质的量之比为1:6 | |
| B. | 5KI+KIO3+3H2SO4=3I2+3K2SO4+3H2O中,氧化产物和还原产物物质的量之比为5:1 | |
| C. | 3S8+24KOH=8K2SO3+4K2S4+12H2O中,被氧化和被还原的S8物质的量之比为2:1 | |
| D. | 3(NH4)2SO4=3SO2+N2+6H2O+4NH3中,反应中发生氧化反应和未发生氧化反应的氮元素物质的量之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
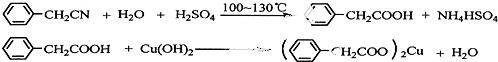
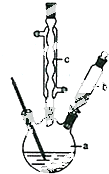
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com